При нулевом пропускании стрелка измерительного прибора должна отклониться на 100 делений.
Оптическая плотность окрашенного раствора измеряется относительно раствора сравнения, для которого концентрация измеряемого вещества принимается равной 0 (дистиллированная вода или проба, которая прошла все этапы подготовки к фотометрии, но которая не содержит исследуемого вещества).
Этот закон справедлив лишь тогда, когда поглощающие свет частицы (молекулы, ионы) не подвергаются диссоциации или другим изменением химического состава (ассоциации, гидролизу, сольватации т.п.), приводящим к изменению числа центров, поглощающих свет. Поэтому при использовании фотометрии для количественного анализа всегда производится проверка применимости закона Ламберта-Бугера-Бера для конкретных условий в интервале всех используемых концентраций.
Исходя из закона, оптическая плотность раствора D прямолинейно зависит от концентрации окрашенного вещества, что может быть подтверждено для конкретных условий графической зависимостью D от C, выражаемой прямой линией (калибровочного графика).
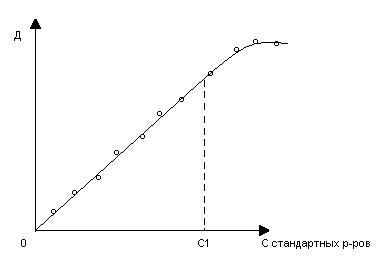
Этот график получают путем
измерения оптической плотности серии стандартных растворов определяемого
элемента. Эти растворы отличаются концентрацией этого элемента и их оптическая
плотность измеряется при длин волны (или с соответствующим светофильтром),
дающей максимальное поглощение (![]() ).
).
Для калибровочного графика, показанного на рисунке, очевидно, что основной закон фотометрии соблюдается на диапазоне изменении концентрации определяемого элемента в фотометрируемом растворе от 0 до концентрации С1. В этой области концентраций и должна измеряться оптическая плотность, по величине которой можно однозначно найти соответствующую ей концентрацию анализируемого элемента в фотометрируемом растворе.
Следует указать, что измеряемые оптические плотности должны лежать винтервале 0,2-2,0 (лучше 0,2-1,0), что обеспечивает приемлемую погрешность измерения оптической плоскости. Наименьшая ошибка измерения соответствует значению D=0,43.
В принципе, имея калибровочный и для больших концентраций, можно и их находить по величине измеренной оптической плотности, но здесь уже будет значительно меньшая плотность, которая будет соблюдаться только в абсолютно одинаковых условиях подготовки и измерения стандартного и анализируемого растворов. Обычно пользуются только прямолинейной частью графика.
Учитывая, что в природе не так
много веществ (элементов, растворов), обладающих интенсивной окраской и видимой
области спектра (![]() нм), чаще всего для
перевода определяемого химического элемента в окрашенном соединение к раствору
этого элемента прибавляют другое вещество – реактив, которое образует с
элементом окрашенное соединение (чаще всего комплексное). По интенсивности
окраски его и определяется концентрация элемента.
нм), чаще всего для
перевода определяемого химического элемента в окрашенном соединение к раствору
этого элемента прибавляют другое вещество – реактив, которое образует с
элементом окрашенное соединение (чаще всего комплексное). По интенсивности
окраски его и определяется концентрация элемента.
Ряд веществ, (например, KMnO4, K2Cr2O7, K2CrO4, CuSO4 и т.п.) обладают своей собственной окраской, по интенсивности которой можно судить об их концентрации, т.е. фотометрировании не нужно вводить окрашивающих веществ (реактива), а методика их определения остается точно такой же, как и с введением реактива.
Если в растворе одновременно
присутствуют два окрашенных вещества, не взаимодействующие друг с другом
химически, их концентрации можно определить путем измерения поглощения при двух
длинах волн, для которых известны коэффициенты поглощения этих веществ. Эти
определения основаны на том, что оптическая плотность растворов смеси окрашенных
веществ при данной длине волны является суммой оптических плоскостей отдельных
компонентов при этой же длине волны. Например, измеренная при этой длине волны
оптическая плотность Dр-ра аддитивно
складывается из оптической плотности первого компонента ![]() и
оптической плотности второго компонента
и
оптической плотности второго компонента ![]() ,
,
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.