Теперь раствор задачи (![]() ) наливаем в колбу
для измерения проводимости и доводим дистиллированной водой так, чтобы «ушко»
электрода было полностью скрыто раствором. Потом начинаем серию измерений
проводимости данного раствора при титровании гидроксидом натрия: сначала без
добавления титранта, потом после добавления 1 мл, после 2 мл и т.д. Причем,
измерения проводят до того момента, как не будет изменения монотонности
проводимости (т.е. скачка или «пика»), после этого проводим еще 5 измерений.
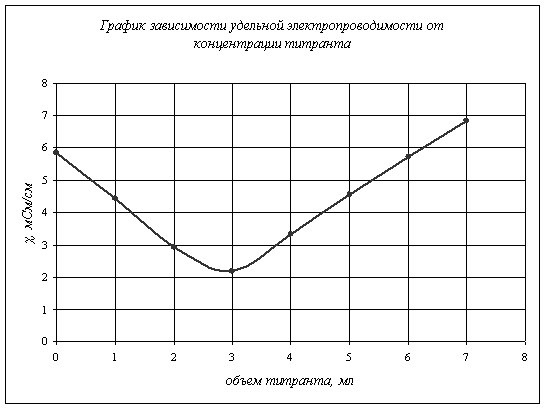
Данные измерений представлены в таблице:
) наливаем в колбу
для измерения проводимости и доводим дистиллированной водой так, чтобы «ушко»
электрода было полностью скрыто раствором. Потом начинаем серию измерений
проводимости данного раствора при титровании гидроксидом натрия: сначала без
добавления титранта, потом после добавления 1 мл, после 2 мл и т.д. Причем,
измерения проводят до того момента, как не будет изменения монотонности
проводимости (т.е. скачка или «пика»), после этого проводим еще 5 измерений.
Данные измерений представлены в таблице:
Таблица 2.
|
Объем титранта, мл |
χ, |
|
0 1 2 3 4 5 6 7 |
5,840 4,440 2,930 2,180 3,320 4,560 5,720 6,830 |
Как видно из таблицы, сначала проводимость монотонно «падала», потом
это «падение» прекратилось и начался медленный рост проводимости.
Следовательно, сначала проводящими ионами были ионы муравьиной кислоты, затем
при добавлении титранта образовывалась соль, степень диссоциации ионов которой намного
ниже, поэтому проводимость «падала», но при дальнейшем добавлении щелочи все
диссоциированные ионы молекул кислоты образовали соль (![]() )
и воду, поэтому проводящими ионами стали активные ионы щелочи, вследствие чего
проводимость стала снова возрастать.
)
и воду, поэтому проводящими ионами стали активные ионы щелочи, вследствие чего
проводимость стала снова возрастать.![]()
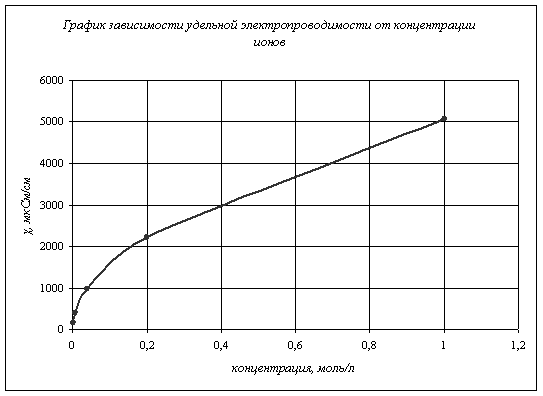
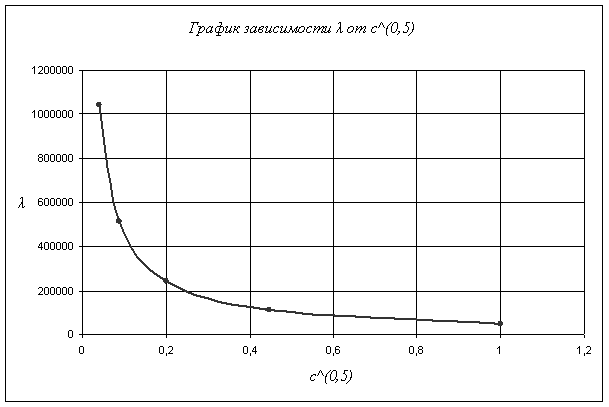
Вычисляем степень диссоциации слабого электролита ![]() , где
, где ![]() ,
,
![]() ,
, ![]() при 18 градусах,
при 18 градусах, ![]() . По графику 1. находим точку
эквивалентности
. По графику 1. находим точку
эквивалентности ![]() ,
, ![]() ,
,
![]() ,
, ![]() .
Причем удельная проводимость задачи берется до того как начинается титрование,
она равна
.
Причем удельная проводимость задачи берется до того как начинается титрование,
она равна ![]() . Тогда
. Тогда ![]() .
Далее подставляя значения степени диссоциации и концентрации задачи находим
константу диссоциации:
.
Далее подставляя значения степени диссоциации и концентрации задачи находим
константу диссоциации: ![]() .
.
Теперь заполним таблицу 1.
Рассчитаем
степень диссоциации и константу диссоциации таким же образом как было описано
выше. Рассчитав константы диссоциации для каждого опыта, найдем
среднеквадратичное отклонение по формуле 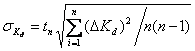 .
Тогда константа диссоциации равна:
.
Тогда константа диссоциации равна: ![]() .
. ![]() , найдем относительную погрешность:
, найдем относительную погрешность: 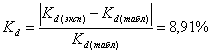 .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.