Указать, какие из перечисленных металлов (бериллий, тантал, хром, кобальт, цинк, магний, железо) и почему следует рекомендовать для эксплуатации в щелочных, а какие - в кислых средах. Привести для этих металлов зависимости скорости коррозии от активности агрессивной среды.
Кислотность коррозионной среды оказывает двоякое влияние на характер протекания коррозии:
- величина pH изменяет величину потенциала водородного и кислородного электродов. Поэтому кислотность оказывает существенное влияние на катодный процесс. На анодный процесс величина pH, как правило, не влияет.
- величина pH оказывает на процесс коррозии косвенное влияние, заключающееся в изменении растворимости продуктов коррозии и возможности образования защитных кроющих пленок.
Исходя из типа зависимости коррозия - кислотность, все металлы принято делить на пять групп (по А. Я. Шаталову). На рис. 1, а—д представлены эти характерные зависимости.
Группа а - металлы, устойчивые в кислой и щелочной среде, скорость коррозии которых практически не зависит от pH. К этой группе относятся золото, платина, серебро.
Группа б — металлы, нестойкие в кислой среде и недостаточно стойкие в нейтральной среде. В сильно щелочной среде (при pH≈14) эти металлы являются стойкими. К этим металлам относятся магний, марганец, железо. Стойкость данных металлов в этой области объясняется тем, что образующиеся на их поверхности гидроксиды, формирующие покровную пленку, не растворяются в щелочной среде. Тем не менее, железо, при рН>14 гидроксид железа растворяется с образованием иона феррата (см. рис. 2).
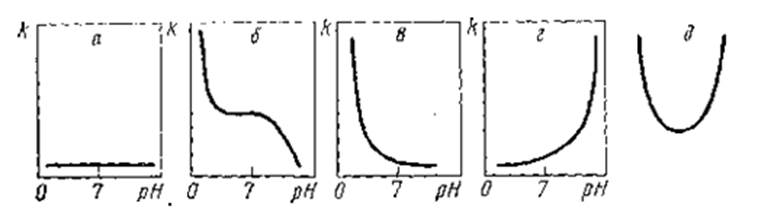
Рис. 1. Виды зависимости коррозия — pH
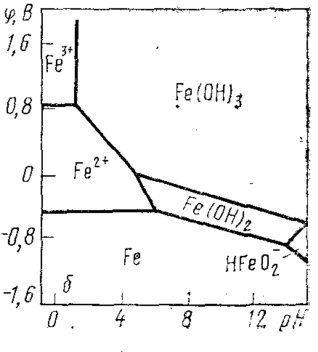
Рис.2 Диаграмма Пурбе для железа.
Группа в — металлы, неустойчивые в кислой среде и устойчивые в нейтральной и щелочной средах. К этим металлам относятся никель, кобальт, кадмий. Гидроксидные пленки металлов отличаются высокими защитными свойствами.
Группа г — металлы коррозионностойкие в кислой среде и неустойчивые в щелочной среде. Металлы, относящиеся к этой группе,— тантал, молибден, вольфрам — имеют кислый характер гидроксидной пленки, которая легко растворяется при взаимодействии со щелочным раствором.
Группа д — металлы, стойкие только в нейтральной среде. К ним относятся алюминий, цинк, олово, свинец. Особенностью этих металлов является образование амфотерных гидроксидов, одинаково хорошо растворяющихся в кислой и щелочной средах.
Таким образом, в зависимости от влияния значения pH среды на коррозионную стойкость указанные металлы можно разделить на группы:
1 железо, хром, магний - в кислой среде нестойкие, в нейтральной среде - недостаточно стойкие, а в щелочной среде скорость коррозии этих металлов по мере увеличения pH падает, достигая минимума при pH = 12-14;
2 кобальт - неустойчив в кислой и достаточно стойки в нейтральной и щелочной средах;
3 тантал - устойчив в кислой и нейтральной средах, но заметно корродирует в щелочной среде;
4 цинк, бериллий - коррозионно-стойкие в нейтральной, но неустойчивые в кислой и щелочной средах.
Минимальная величина pH при 25° С, при которой коррозия не протекает, составляет для алюминия 6,5; для свинца 8,0; олова 8,5; цинка 11,5; железа 14.
Для тех областей pH, в которых наблюдается ускорение коррозии, А. Я. Шаталов предложил следующие уравнения для расчета скорости коррозии:
![]()
В этих уравнениях k' и k" — коэффициенты пропорциональности, а H+- и OH- -активности водородных и гидроксильных ионов. Показатель степени n в первом уравнении имеет величину: для магния и марганца 2, для цинка 1,1, для железа 0,42, для олова 0,13. Показатель степени т во втором уравнении составляет для алюминия 0,63.
3. Описать способы борьбы со склонностью нержавеющих хромоникелевых сталей аустенитного класса к межкристаллитной коррозии. Указать, в чем состоит сущность испытания этих сталей на межкристаллитную коррозию по методу АМ.
Межкристаллитная коррозия возникает в поликристаллических сплавах и состоит в их ускоренном растворении в области границ зерен.
Межкристаллитной коррозии подвержены легко пассивирующиеся
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.