РАСТВОРЫ
Растворимость S: S = mв-ва [г/100 г р-ля]
100 г р-ля
Молярная растворимость L: L = S/Мв-ва, где Мв-ва – молекулярная масса вещества, г/моль
Концентрации
1. Процентная концентрация (массовая доля) ω : ω =m в-ва, [%, доли ед.]
mр-ра
где m в-ва – масса растворенного вещества, г;
mр-ра – масса раствора, г.
2. Молярная концентрация СМ: СМ (В)= n(В) , [моль/л ]
Vр
где n(В) – количество вещества, моль,
Vр – объем раствора, л.
n(В) = mв-ва , [моль]
М(В)
3. Молярная концентрация эквивалента Сэк (нормальная концентрация Сн)
Сэк(В)= nэк , [моль·эк]
Vр л
Количество эквивалентов растворенного вещества:
nэк = mв-ва , [моль·эк]
Мэк(В)
где Мэк(В) – молярная масса эквивалента вещества, г/ моль·эк
Мэк(В) =М(В)·fэк
fэк для кислот, оснований, солей определяется по формуле:
fэк = 1 .
заряд иона·число ионов
СМ (В)= Сэк(В) · fэк
Закон эквивалентов для реакций в растворах:
Сэк(В1)· V1 = Сэк(В2)· V2
nэк (В1) = nэк (В2)
4. Титр Т: Т(В) = mв-ва [г/мл]
Vр-ра
Т(В) = Сэк(В)·Мэк(В)
1000
5. Моляльная концентрация Сm: Сm = n (В) [моль/кг]
m р-ля
mр-ра = mв-ва +mр-ля
6. Молярная доля вещества (мольная доля) N
N(B) = n(B) .
n(B) + n(H2O)
Законы Рауля
Ι (тонометрический) закон Рауля: p0A – pA = ΔpA = p0A· N(В), где p0A, pA – давление насыщенного пара растворителя соответственно над чистым растворителем и над раствором;
ΔpA – разность между давлением насыщенного пара растворителя над растворителем p0A и раствором pA;
N(В) – молярная доля растворенного нелетучего вещества.
ΙΙ (эбуллиоскопический и криоскопический) закон Рауля:
ΔТкип = Кэ·Сm,
ΔТкрист = Кк·Сm,
где ΔТкип – повышение температуры кипения;
ΔТкрист – понижение температуры кристаллизации;
Кэ – эбуллиоскопическая константа растворителя;
Кк – криоскопическая константа растворителя;
Сm – моляльная концентрация раствора.
Степень диссоциации α - α = n [доли единицы]
N или %
Сильные электролиты (α ≥ 30%) в растворе полностью диссоциируют на ионы:
1) кислоты – HCl, HBr, HI, HNO3, HClO3, HClO4, HMnO4, H2SO4.
2) основания – NaOH, KOH, LiOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2.
3) соли – все растворимые в воде соли.
Слабые электролиты (α≤3 %) частично диссоциируют на ионы при растворении в воде:
1) почти все органические кислоты (НСООН, СН3СООН, Н2С2О4 и другие).
2) некоторые неорганические кислоты (HF, HCN, H2S, HClO, HClO2, HNO2, H2SiO3, H2SO3, H2CO3, H3AsO4, H3PO4).
3) NH4OH, а также все основания металлов, кроме сильных оснований.
4) водаH2O.
В растворах слабых электролитов: КА <=> К+ + А-
Константа диссоциации слабого электролита: Кд = [К+]·[А-]
[КА]
Закон разбавления Оствальда: Кд = с · α2 .
1 – α
Для очень слабых электролитов α << 1, поэтому принимают Кд равной
Кд = с ·α2
где с – концентрация слабого электролита, моль/л.
Произведение растворимости
Запишем ПР в общем виде: ПР (AnBm) = [Am+]n·[Bn-]m.
AnBm (т)<=> nAm+ + mBn-
Например: Ca3(РO4)2 <=> 3 Ca2+ + 2 РO43-
ПР(Ca3(РO4)2) = [Ca2+]3·[ РO43-]2.
Ионное произведение воды КН2О. КН2О = [Н+]·[ОН-] = 1·10-14 моль/л
Водородный показатель рН: рН = - lg [Н+].
Гидроксильный показатель рОН: рОН = - lg [ОН-]
рН + рОН = 14.
Степень гидролиза hг: hг = Сгидр
С
Константа гидролиза Кг: Кг = КН2О .
КД слабого электролита
hг = 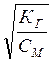 =
= 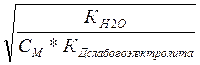
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.