Пример решения
Определить напряжение на электролизной ванне, в которой используются электролиты из меди и цинка. Площадь электрода S=0,15м2 , расстояние между электродами L=0,1м . Сила тока 3А, удельная электропроводимость электролита К=0,13 Ом·м . Анодный и катодный потенциал Ua = +0.34 B ; Uk = -0,76 В.
Решение:
1. ![]() В
В
2. Падение напряжения на электролите, В
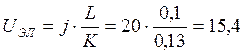 В
В
3. Плотность тока, А/м2
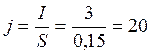 А/м2
А/м2
L – расстояние между электродами, м
К - удельная электропроводимость электролита, Ом·м .
I - Сила тока,A
S - Площадь электрода,м2
Ответ: U = 14,96 В.
Задачи для решения
1. Найти массу основы, габариты которой S = 850,89 мм, полученной за 12 ч, наращивания никеля при электродной плотности тока D =
270 А/м2 и выходе по току ![]() = 0,98. Плотность
никеля p = 8,9 г/см3.
= 0,98. Плотность
никеля p = 8,9 г/см3.
2.Рабочее напряжение на ванне
рафинирования никеля равно 3,2 В, потери напряжения составляют ![]() U=3 % от напряжения на ваннах; выход по току
U=3 % от напряжения на ваннах; выход по току ![]() = 96 %. Найти Wу - удельный расход электроэнергии на 1 тонну
рафинированного никеля.
= 96 %. Найти Wу - удельный расход электроэнергии на 1 тонну
рафинированного никеля.
3.В электролизном цехе установлено 2 цепи товарных ванн с напряжением каждой цепи 365 В и одна цепь с напряжением 70 В. При одинаковой силе тока I = 20 кА во всех цепях, найти общую мощность электролиза, найти суточный расход электроэнергии (t = 24 ч) и удельный расход электроэнергии на 1 тонну, если суточная производительность m = 140 т.
4. Найти толщину одного никелевого анода
δ, если плотность никеля p = 8,9 г/см3, габариты анода S = 850,980 мм, плотность тока D = 300 А/![]() , а выход по току η=0,98.
Время наращивания t = 24 ч.
, а выход по току η=0,98.
Время наращивания t = 24 ч.
5. Найти первоначальную массу одного анода, если продолжительность работы анода площадью S = 0.64 м2 составляет 25 суток. Электродная плотность тока D = 220 А/м2 ; выход скрапа mск= 17 %, шлама mшл= 5% от от первоначальной массы анода. Выход по току D = 98 %.
6. Найти массу и
толщину анода, полученного за 10 суток наращивания никеля при электродной плотности
тока D = 300 А/![]() и выходе по току η=0,98. Площадь
анода S = 0,756 м2. Плотность никеля p = 8,9 г/см3. Электрохимический
эквивалент никеля q =1,095.
и выходе по току η=0,98. Площадь
анода S = 0,756 м2. Плотность никеля p = 8,9 г/см3. Электрохимический
эквивалент никеля q =1,095.
7. Найти удельный расход электроэнергии на 1 тонну рафинированного никеля за 1 сутки (24 часа) электролизного цеха в котором установлено 3 серии по 80 ванн, если напряжение на одной ванне рафинирования никеля равно 3,2 В,а сила тока в каждой цепи равна 20 кА. Производительность цеха за 1 сутки принять равной 136 тонн.
8. Определить
необходимую плотность тока для того, чтобы получити 30 кг. Никеля на одном аноде за 5 суток, если выход по току η=0,98. Электрохимический
эквивалент никеля
q =1,095. Площадь анода S = 0.862 ![]() .
.
9. Определить проводимость электролита в электролизной ванне, если известно, что напряжение на ванне 50 В, электродная плотность тока 10 А/м2, глубина погружения электрода в ванну lп=0,8 м, радиус электрода 0,09 м, а расстояние между электродами 2,5 м.
10.Найдем общее количество анодно- растворенного хлористого натрия с учетом выхода по току, если известно, что удельный объемный съем металла Qуд=90 см3/мин, длительность прохождения тока t=10 мин, длина столба между электродами l=120 см, расчетная площадь S=500 см2, удельная электропроводность χ0=1,07 г/см3, напряжение приложенное к электродам U=100 В.
11.Определить объем растворенного при ЭХО алюминия Vо, если фактическая масса растворенного металла 200 г, масса вещества 510г. Сила тока проходящая через электролит 5 А, а время электролиза τэ=0,5 минут.
12. Определить выход металла по энергии Аэ. Если напряжение электро-химического разложения вещества, меди U1=0,32В, анодное и катодное падение потенциала Uа=0,13В, Uк=0,2В, электрохимический эквивалент меди α=0,3294·10-6 кг/Кл, фактическая выделившееся количества вещества q1=0,00982.10-23кг, количества вещества, которое должно было выделиться по закону Фарадея при отсутствии электрических потерь q2=1,055 .10 -25кг.
13. Найти мощность, выделяющуюся в электролизной ванне, если известно напряжение в электролизной ванне U=50В, электродная плотность тока јэ=10А/м2, глубина погружения в ванну lп=1м, радиус электрода R=0,1м, расстояние между электродами l=0,5м, напряжение электрохимического разложения вещества U1=10В, анодное падение потенциала Uа=15В, катодное падение потенциала Uк=20В.
14. Какую температуру будет иметь образовавшийся водный раствор, если известно, что температура пара t1=1000С, температура холодного раствора t2=100С, удельная теплота парообразования r=2,3·106 Дж/кг, удельная теплоемкость с=4190 Дж/(кг·К).
15. Ток силой I=100 кА пропускали через расплавленную смесь криолита и глинозема в течении t=2 часов. Вычислить массу mal выделившегося на катоде алюминия и VO2 объем выделившегося кислорода (условия нормальные). М=27 г/моль, коэффициенты n=3, F=96500.
16. Задача: Определить объём растворённого при электрохимической обработки алюминия V0, если его фактическая масса Мф=260 г, сила тока 10000А; универсальная постоянная С=6,2176·10-4 г/А·мин; время электролиза τэ=5 мин; атомная масса алюминия А=26,98; валентность n=3; объёмный электрохимический эквивалент Кv=2,07·10-3 см3/А·мин.
17. Сколько атомов двухвалентного алюминия выделились за 5 мин на катоде, площадь поверхности которого равна S=150 см2, если электролиз производили при плотности тока j=10 А/м2?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.