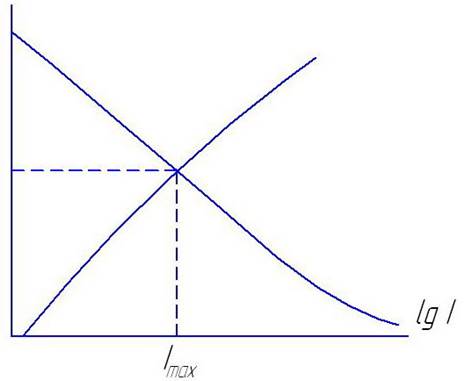
При каждом потенциале необходимо определить ток саморастворения и наложенный внешний ток. Сумма их дает величину общего тока. Эти величины будут выражать абциссы точек идеальной катодной или анодной кривых (в зависимости от того, что мы строим и какой ток измеряли) от задаваемым потенциалом.
Ток саморастворения определяют, устанавливая скорость собственной коррозии электрода весовым или объемным методом.
Многоэлектродные системы
Все, что мы рассмотрели относительно механизма электрохимической коррозии, относилось к двухэлектродной системе. В практических условиях, учитывая гетерогенность металлической поверхности, имеет место взаимодействие с эл-том разнородных структурных составляющих примесей, содержащихся в металле.
На коррозионный процесс влияет также неоднородность электролита, т.е. неодинаковые концентрации составляющих электролита и кислорода, разная степень нагрева и т.д. Т.е. как правило в практике мы имеем дело с много электродными системами причем короткозамкнутыми.
Решение проблемы многоэлектронного элемента в первом приближении подразумевает возможность теоретического определения какие электроды данной системы будут работать анодами, какие – катодами.
В полном решении необходимо включить количественный расчет силы тока на каждом электроде.
Решение короткозамкнутого многоэлектродного гальванического элемента исходит из двух довольно очевидных утверждений.
1. Если система замкнута накоротко во внешней и во внутренней цепи, то потенциал ее составляющих вследствие явления поляризации выравнивается около какого-то общего потенциала Vx.
2. Если система находится в стационарном состоянии, т.е. в отдельных ее точках не происходит накопления зарядов во времени, то сумма всех катодных токов системы равна сумме всех анодных токов.
Дадим графическое решение многоэлектродных заполяризованных систем исходя из идеальных поляризованных кривых.
строим на диаграмме в координатах V - I анодных и катодных поляризованных кривых для каждого металла. Для простоты
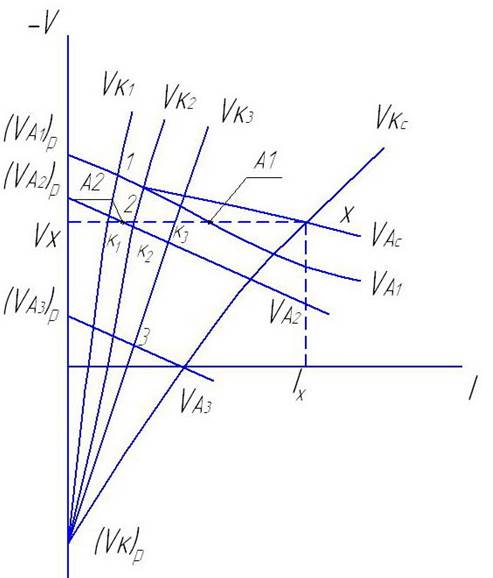
VК1; VК2; VК3 - катодные пол. кривые
VА1; VА2; VА3 - анодные -//-
точки 1, 2, 3 соответствуют величине тока коррозии и стационарного потенциала при отсутствии контакта с другими металлами.
Суммирует вес анодные токи – получают суммарную анодную кривую. Точка пересечения этих кривых соответствует суммарной силе тока и значению стационарного потенциала системе Vx.
При пересечении катодных кривых с горизонталью Vx Х получаются отрезки VxК1; VxК2; VxК3 - длина каждого из которых характеризует величину катодного тока данного металла. Таким образом у всех металлов сохраняются катодные функции при работе многоэлектродной системе, т.е. через них протекает катодный ток.
При пересечении анодных кривых с этой же горизонталью получаются отрезки VxА1 и VxА2 , которые соответствуют величине анодного тока данного Ме. Анодные функции сохраняются не у всех металлов, а только у тех, обратимый (равновесный) потенциал которого отрицательнее общего потенциала системы.
Величина тока, подаваемого данным Ме во внешнюю цепь (Iп)внеш , соответствует разности его катодного и анодного токов.
(Iп)внеш = IКп - IАп
полярность каждого Ме определяется знаком этой разности: + катод, - анод. В данной системе 1 Ме – анод. 2-й и 3-й катоды, причем у 2-го частично сохраняются функции анода (имеет место саморастворение), у иретьего полностью отсутствуют анодные функции (нет саморастворения) он работает только как катод.
Суммарный внешний ток многоэлектродной системы равен сумме всех анодных или катодных внешних токов.
(Iх)внеш = ∑(Iп)внеш
Величина тока саморастворения (внутреннего тока) анодных Ме равна их катодному току.
(IА)внут = IКп
Величина тока саморастворения катодных Ме, равна их анодному току
(IА)внут = IАп
Суммарный внутренний ток многоэлектродной системы можно получить, просуммировав анодные внутренние токи всех металлов системы.
Разностный эффект
Разностным эффектом или деференц-эффектом называется явления (изменения, уменьшения) тока саморастворения Ме под влиянием анодной поляризации (либо подключение вненего источника тока, либо контакта с более электроположительным металлом).
 |
![]()
|
|
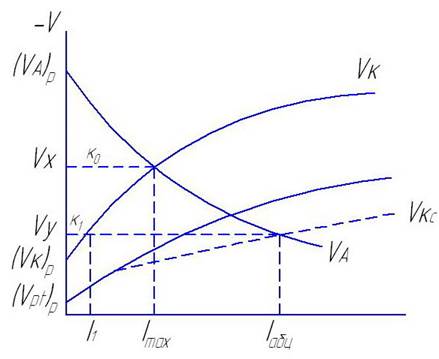
Возьмем к примеру подключим к Zn находящийся в разбавленной кислоте платиновый электрод.
На поляризационной диаграмме Zn нарисуем катодную кривую для платины и получим суммарную поляризованную катодную кривую.
До подключения платины IА = IК = Imax , а потенциал системы (Zn) Vx.
При подключении Pt катодный ток саморастворения уменьшится и при установившимся для новой системы потенциале будет равен I.
ΔК = К0 – К1 - разностный эффект.
Если при анодной поляризации (т.е. подключения внешнего поляриз. Ме) собственная коррозия уменьшается, то разностный эффект называется положительным. В противном случае называется отрицательным.
В большинстве случаев имеет место положительный разностный эффект.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.