Содержание
1. f(P, V, T)=0 уравнение состояния
R – молярная газовая постоянная. Менделеев связал уравнение Клапейрона с законом Авогадро.
PVm=RT уравнение идеального газа.
Полагая, что моль газа находится в нормальных условиях: P0=1,013*105 Па, T0=273,15K, Vm=22.41*10-3 м2\моль, R=8,31 моль*К.
Для вывода основного уравнения молекулярно-кинетической
теории рассмотрим одноатомный идеальный газ, его молекулы движутся хаотически.
Выделим на стенке сосуда площадку ΔS. Число молекул,
ударяющихся о площадку равно: nΔSvΔt, при столкновении
они передают площадке импульс: P=2m0v*1\6*nΔSvΔt=1\3nm0v2ΔSΔt. Тогда давление газа, оказываемое на стенку сосуда равно:
P=ΔP\(ΔSΔt)=
1\3nm0v2
средняя квадратичная скорость 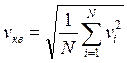 ,
характеризует всю совокупность молекул газа. Из двух последних выводится основное
уравнение молекулярно-кинетической теории
,
характеризует всю совокупность молекул газа. Из двух последних выводится основное
уравнение молекулярно-кинетической теории ![]() учитывая
что n=N/V,
учитывая
что n=N/V,
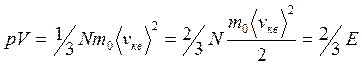 Е – суммарная кинетическая энергия
поступательного движения всех молекул газа.
Е – суммарная кинетическая энергия
поступательного движения всех молекул газа.
Но с другой стороны: если V=Vm –
молярный объём, m0=M – молярная масса и PVm=RT, то уравнение примет следующий вид: ![]()
2. Внутренняя энергия [U] – Энергия хаотического движения и взаимодействия микрочастиц системы. однозначная функция термодинамического состояния системы, не зависящей от того как система пришла в данное состояние.
Энергия поступательного движения:
![]()
Средняя энергия молекулы: ![]() , где i – число степеней свободы
, где i – число степеней свободы ![]()
Энергия идеального газа, где
взаимная потенциальная энергия молекул равна 0: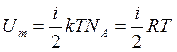
3. Рассмотрим термодинамическую систему. Механическая работа которой неизменяема, только Внутренняя, за счёт совершения над системой работы или сообщения ей теплоты.
Допустим, что некоторая система, обладая некоторой внутренней энергией U1 получила некоторое количество теплоты Q и перешла в новое состояние с внутренней энергией U2, совершила работу А против внешних сил. Теплота положительна, когда она подводится к системе, а работа – когда она совершается против внешних сил. Изменение внутренней энергии: ΔU=U2-U1. Изменение энергии равно разности теплоты и работы: ΔU=Q-A или Q=ΔU+A это уравнение выражает первое начало термодинамики: теплота, сообщаемая системе расходуется на изменение внутренней энергии системы и на совершение ею работы против внешних сил.
Продифференцируем: dQ=dU+dA в более корректной форме: δQ=dU+δA, в этом выражении полным дифференциалом является только энергия, а работа и теплота таковыми не являются.
Если A=Q получается вечный двигатель первого рода.
Адиабатическим называется процесс, при котором отсутствует теплообмен (δQ=0) между системой и окружающей средой. Как правило это быстропротекающие процессы.
Из первого начала термодинамики: δA=-dU т.е. внешняя работа совершается за счёт внутренней энергии системы. С - на 103
Из уравнения идеального газа: 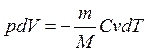 где Сv=iR/2-молярная теплоёмкость при постоянном объёме, равна
отношению изменения внутренней энергии к повышению температуры.
где Сv=iR/2-молярная теплоёмкость при постоянном объёме, равна
отношению изменения внутренней энергии к повышению температуры.
Продифференцировав уравнение
идеального газа получим: 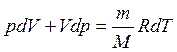
Исключим температуру: 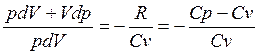 учитывая что
учитывая что 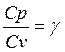 найдём
найдём
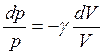
Проинтегрируем полученное
уравнение в пределах от р1 до р2 и соответственно V1 и V2, а
затем потенцируя: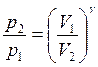 или
или ![]() следовательно
уравнение адиабатического процесса
следовательно
уравнение адиабатического процесса ![]() ещё
оно называется уравнением Пуассона (
ещё
оно называется уравнением Пуассона (![]() - показатель адиабаты)
- показатель адиабаты)
4. Второе начало термодинамики определяет направление протекания термодинамических процессов. ЕГО можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах.
Формулировка по Кельвину: невозможен круговой процесс, единственным
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.