



Министерство образования и науки Российской Федерации
Федеральное агенство по образованию
Государственное образовательное учреждение высшего профессионального образования
«Сибирский Федеральный Университет»
«Институт Цветных металлов и материаловедения»
Институт (факультет) Химико-Металлургический
Кафедра АПП
Специальность 220301
Группа АМЦ 06-01
Измерение рН потенциометрическим методом
Преподаватель Федорова Н. В.
(подпись, дата) (ученое звание, степень, инициалы, фамилия)
Разработал студент Лежепёкова П.О.
(подпись, дата) (инициалы, фамилия)
Красноярск, 2009
Автоматический контроль и регулирование концентрации водородных ионов имеет важное значение при флотационных и гидрометаллургических процессах переработки полезных ископаемых.
Растворы, содержащие диссоциированные на катионы и анионы молекулы, называются электролитами. Понятие степени электролитической диссоциации (активности) как отношения количества диссоциированных молекул к общему количеству молекул вещества, растворенного в определенном объеме растворителя, связано с величиной концентрации С данного раствора. Естественно, что чем больше молекул рассоренного вещества в данном объеме, т.е. чем выше концентрация раствора, тем больше будет в нем диссоциированных молекул. Поэтому в идеальном растворе, где диссоциированных все молекулы, степень электролитической диссоциации численно равна концентрации раствора С. Однако в реальных растворах это равенство несправедливо. При этом с увеличением концентрации степень диссоциации относительно уменьшается, эта связь определяется соотношением:
α= f * C,
где f - коэффициент активности.
Чем концентрированнее раствор, тем меньше коэффициент активности. При бесконечном разведении, когда диссоциируют практически все молекулы, f =1 и раствор по своим свойствам приближается к идеальному.
Для сравнения силы электролитов использовать величину L можно только при равных концентрациях, что на практике весьма неудобно. Поэтому вводится понятие константы электролитической диссоциации K, которая представляет собой отношение активных концентраций диссоциированных и недиcсоциированных молекул:
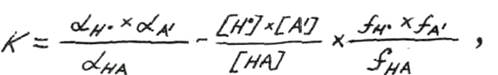
где α - активности [ ] - концентрации, f – коэффициенты активности катионов водорода и анионов диссоциированных молекул раствора.
В воде и в водных растворах имеет место равновесие между недиссоциированными молекулами воды, с одной стороны, и ионами водорода и гидроксина, с другой: Н 2О =Н 0 +ОН’
Для воды константа равновесия
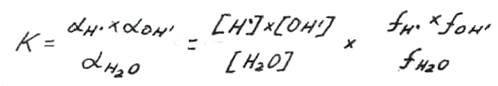
Так как вода ионизирована в очень слабой степени, то концентрации ионов невелики и их коэффициенты активности, а также коэффициент активности неионизированных молекул могут быть приняты равными единице, т.е. в чистой воде и в сильно разбавленных растворах активности можно заменить соответствующими концентрациями, тогда
[H 0] [OH ‘]
K= --------------- или К[H 2O]= [H 0] [OH ‘]
[H 2O]
В связи с очень малой ионизацией воды концентрацию ее недиссоциированных молекул также можно считать постоянной, тогда обозначив
К[H 2O]=К Н2О имеем К Н2О = [H 0] [OH ‘]=const.
Коэффициент К Н2О , равный произведению концентраций ионов H 0 и OH ‘ , называется ионным произведением воды. Его величина для данной температуры строго постоянна не только для чистой воды, но и для любых разбавленных водных растворов кислот, оснований и солей. В результате точных исследований определены значения ионного произведения воды при различных температурах.
В интервале температур 20-250 С ионные произведение К Н2О = 10-14.
Постоянство величины К Н2О позволяет для любого водного раствора
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.