аy(2s) + (10 - а)y(2р) (10.9)
Величина
(10 - а)/а заменяет коэффициент l. При чистом s-состоянии а = 10, при чистом р-состоянии
а = 0. В зависимости энергии связи от величины а максимум
приходится на значение а = 3¸4. Энергия связи,
соответствующая чистым s- и р-состояниям значительно меньше.
Полинг и Шерман предложили считать, что величина энергии связи обусловлена не
интегралом перекрывания, а “силой” отдельных орбиталей. Т.е. сила связи пропорциональна
произведению “сил” двух взаимодействующих орбиталей ya и yb.
Сила h р-орбитали ya определялась как максимальное значение этой функции
при заданном r, нормированной так, что для чистой s-орбитали
получалось значение 1.0. Соответственно h для р-орбитали
равна ![]() , для dz2-орбитали
–
, для dz2-орбитали
– ![]() , для dx2-y2 – орбитали –
, для dx2-y2 – орбитали – 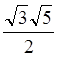 . Для
тетраэдрической гибридной АО (с волновой функцией
. Для
тетраэдрической гибридной АО (с волновой функцией 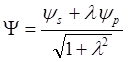 ):
):
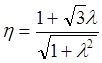 (10.10)
(10.10)
Теперь, зная силы отдельных АО, можно вычислить силу любой гибридной АО:
h = ahs + bhp +chd + dhf, (10.11)
где a, b, c и d – доли s, p, d и f АО, соответственно. Представление о силе орбиталей полезно, однако, оно хуже объясняет изменения в энергии, чем интеграл перекрывания (S). Так по Полингу порядок изменения энергии связи в ряду этан, этилен, ацетилен обратен к наблюдаемому в опыте.
10.6. Двойная связь в этилене.
Связь в этилене можно рассматривать как суперпозицию s-связи, образованной перекрыванием двух тригональных sp2 АО, и p-связи от несмешанных рz-электронов. Другой гипотетический способ образования связи: взаимодействие двух тетраэдрических гибридных sp3 АО. Однако, sp3гибридные АО перекрываются слабо из-за геометрии молекулы: они не могут быть направлены одна к другой. Модель связи с участием тригональной гибридизации подтверждается экспериментально измеренным валентным углом, равным 1200, а не 109028¢ (как при sp3-гибридизации). Добавлением подходящих орбиталей, соответствующим более высоким значениям энергии (d- и f-атомные орбитали) можно добиться ещё большей концентрации зарядового облака гибридизированной АО (большей, чем в случае sp3-гибридизации). Достигаемая при этом большая способность к перекрыванию обусловлена частичным возбуждением 3d- и 4f-уровней (энергетически менее выгодных). Поэтому брать их выгодно лишь с малым вкладом. Так по Полингу оптимальная гибридная смесь содержит 2.5 % d- и f-состояний.
10.7. Гибридизация и напряжение.
Энергия двойной связи в этилене меньше удвоенной энергии простой связи (простая связь - 80 ккал.моль, двойная - 146 ккал.моль). Данный факт, как уже говорилось выше, обусловлен различными типами простой и двойной связи. Двойная связь представляет собой либо сумму s-связи (sp2-гибридизация) и p-связи (pz-электроны), либо образуется за счёт перекрывания sp3-гибридизированных электронов. Но в последнем случае возникает напряжение, что и приводит к понижению энергии связи. Правильнее считать, что причина уменьшения энергии связи заключается в изменении типа гибридизации под влиянием геометрии молекулы. В молекуле циклопропана двойные связи отсутствуют. В этом случае мы имеем sp3-гибридизацию и связи С-С направлены в сторону соседних атомов насколько это возможно. Оптимальный угол 1040. Поэтому связи несколько изогнуты. Уменьшение перекрывания изогнутых орбиталей соответствует потере в энергии связи »7.5 эВ на молекулу. Энергия напряжения возникает не только в соединениях углерода, но и в многоатомных молекулах других элементов. Так в молекуле элементарного фосфора Р4 связи близки к р-типу и поэтому углы между связями Р-Р должны быть равны 900. На самом деле они составляют 600, т.к. молекула Р4 представляет собой тетраэдр. Из-за изгиба связей потери в энергии связи достигают 0.77 эВ на связь. Такое уменьшение перекрывания может быть частично скомпенсировано подходящей примесью d-орбитали (что для фосфора проще, чем для углерода, т.к. размеры первого больше). По Полингу гибридной орбитали в Р4, соответствующей минимуму энергии, соответствует волновая функция:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.