|
№ |
Добавлено NaOH; см3 |
Концентрация |
[H+] |
[OH-] |
pH |
|
|
Ск |
Сщ |
|||||
|
1 |
0.0 |
0.25 |
0.6020 |
|||
|
2 |
10.0 |
0.2090 |
0.6798 |
|||
|
3 |
20.0 |
0.1750 |
0.7569 |
|||
|
4 |
30.0 |
0.1461 |
0.8353 |
|||
|
5 |
40.0 |
0.1214 |
0.9157 |
|||
|
6 |
50.0 |
0.1000 |
1.0000 |
|||
|
7 |
60.0 |
0.0812 |
1.0904 |
|||
|
8 |
70.0 |
0.0647 |
1.1890 |
|||
|
9 |
80.0 |
0.0500 |
1.3010 |
|||
|
10 |
90.0 |
0.0368 |
1.4341 |
|||
|
11 |
100.0 |
0.0250 |
1.6020 |
|||
|
12 |
110.0 |
0.0142 |
1.8477 |
|||
|
13 |
120.0 |
0.0045 |
2.3467 |
|||
|
14 |
124.0 |
0.0008 |
3.0492 |
|||
|
15 |
124.9 |
0.00008 |
4.0510 |
|||
|
16 |
125.0 |
0.00000 |
7 |
|||
|
17 |
125.1 |
0.00008 |
9.9486 |
|||
|
18 |
126.0 |
0.0008 |
10.9466 |
|||
|
19 |
135.0 |
0.0085 |
11.9299 |
|||
|
20 |
150.0 |
0.0200 |
12.3010 |
|||
Выделенные строки в таблице соответствуют началу скачка- строка 15, точке эквивалентности- строка 16, концу скачка- строка 14.
По данным таблицы построим график кривой титрования:
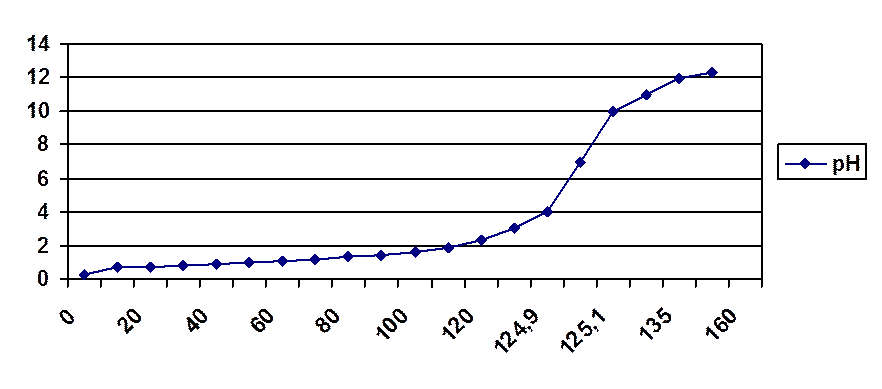
Добавлено NaOH (см3)
Ход кривой, слева направо характеризует изменение pH при титровании кислоты щелочью. Наоборот, справа налево- соответствует изменению pH при титровании щелочи кислотой.
Рассматривая кривую титрования, прежде всего, замечаем, что точка эквивалентности совпадает в данном случае с точкой нейтрализации (pH=7). Далее обращает на себя внимание чрезвычайно резкий скачок pH при переходе от 0,1 см3 избытка кислоты к 0,1 см3 избытка щелочи. Значение pH при этом изменяется на 5,8 единицы (от 4,05 до 9,94). Какие же выводы можно сделать из особенностей кривой титрования в отношении выбора индикатора?
Выбор индикатора
На первый взгляд может показаться, что должен быть употреблен такой индикатор, окраска которого меняется про pH =7, т.е. в точке эквивалентности. Например лакмус или бриллиантовый синий, показатели титрования которых около7.
Однако, если учесть, отмеченный выше скачок pH на кривой титрования, то станет ясно, что с таким же успехом можно было бы применить. Например, метиловый оранжевый, хотя с ним титрование заканчивается не при pH=7, а при pH=4, или фенолфталеин(pH раствора будет 9,7). Вследствии несовпадения pT выбранного индикатора и pH титруемого раствора в точке эквивалентности, раствор обычно либо несколько раз перетитровывают, либо, наоборот, недотитровывают. В результате, по окончании титрования, раствор содержит некоторый избыток свободной кислоты или свободной щелочи. Если значение pT<pH в точке эквивалентности, то ошибка называется избытком Н+- иона и называется водородной «Н+ - ошибкой».
В противном случае, когда pT>pH, ошибка вызвана избытком ОН- и называется гидроксильной «ОН- - ошибкой». Важен знак ошибки. Если титруют кислоту и получают Н+ - ошибку, то какая-то часть кислоты остается неоттированной, и ошибка получается со знаком минус (-). Наоборот, если при титровании кислоты получают ОН- - ошибку, то ошибка имеет знак (+), так как вызвана избытком ОН- - ионов.
Рассчитаем индикаторную ошибку титрования. Возьмем индикатор метилоранж, для которого pT=4. Воспользуемся формулой:
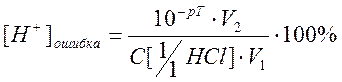
где pT- показатель титрования индикатора;
V1- первоначальный объем кислоты, см3;
V2- объем раствора в конце титрования, см3
![]() -
молярная концентрация кислоты.
-
молярная концентрация кислоты.
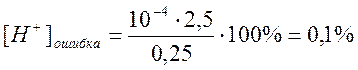 .
.
Величина 0,1% не выходит за обычные пределы аналитических погрешностей, следовательно, метиловый оранжевый применять можно.
Для фенолфталеина речь идет о гидроксильной ошибке титрования.
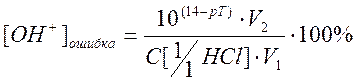
Получаем:
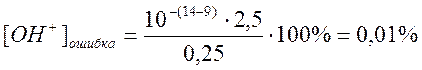
Таким образом, и фенолфталеин для титрования вполне пригоден.
Из всего вышеприведенного нетрудно сформулировать основное правило выбора индикатора титрования: для каждого данного титрования можно применять только те индикаторы, показатели титрования которых лежат в пределах скачка pH не кривой титрования.
Литература:
Зингель Э.М., Бабий Т. Я., Балуева Г.К.
Аналитическая химия. Расчет кривых титрования: Учебное пособие для студентов специальностей 2506, 2603, 2603с, 3207 дневной и заочной формы обучения.
- Красноярск: СибГТУ, 2002 – 38с.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.