Существуют два предельных случая в
зависимости от соотношения констант скоростей. Константа скорости второй стадии
намного больше константы скорости обратной реакции. Тогда ![]() . При этом можно оценить влияние уходящей
группы (Hal). Наблюдается следующая закономерность:
. При этом можно оценить влияние уходящей
группы (Hal). Наблюдается следующая закономерность: ![]() как уходящие группы. Энергетический
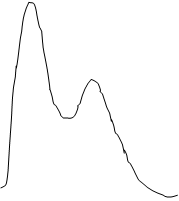
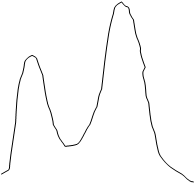
профиль реакции может быть схематично представлен так:
как уходящие группы. Энергетический
профиль реакции может быть схематично представлен так:
|
|
|
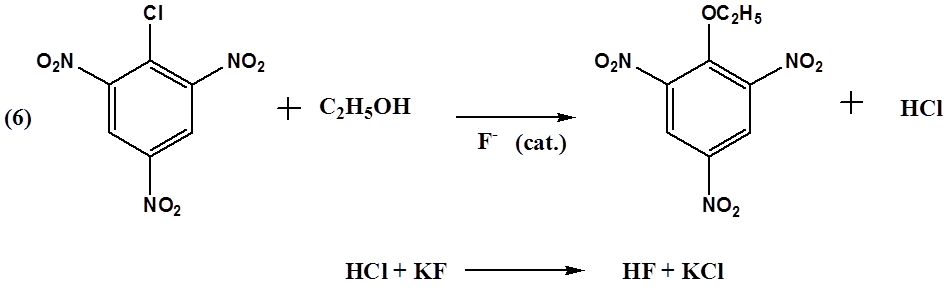
Пикрилхлорид (соединение 1) является удобным объектом для изучения кинетики нуклеофильного замещения в ароматическом кольце. Влияние трёх акцепторных заместителей совпадает, поэтому замещение галогена протекает с заметной скоростью.
В данной работе нами изучалась реакция пикрилхлорида с
этиловым спиртом в присутствии фторид-ионов как катализатора. Механизм катализа
обсуждается. Существуют предположения, что при взаимодействии фторид-аниона и
молекулы спирта образуется алкоголят-анион и плавиковая кислота: ![]() . Алкоголят-анион является более мощным
нуклеофилом, чем молекула спирта.
. Алкоголят-анион является более мощным
нуклеофилом, чем молекула спирта.
Более ранние исследования показали, что зависимость скорости реакции (6) от концентрации фторид-ионов близка к экспоненциальной. Поэтому, чтобы получить более простую зависимость, эксперимент проводили в разбавленном растворе фторида калия в этиловом спирте.
Скорость реакции прямо пропорциональна концентрации
фторид-аниона в первой степени: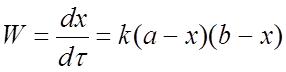 . Величины α и b –
начальные концентрации пикрилхлорида и фторида калия соответственно, k –
константа скорости реакции, вообще говоря, зависящая от концентрации
катализатора. Множитель (b-x) связан с расходованием фторида калия в реакции с
соляной кислотой.
. Величины α и b –
начальные концентрации пикрилхлорида и фторида калия соответственно, k –
константа скорости реакции, вообще говоря, зависящая от концентрации
катализатора. Множитель (b-x) связан с расходованием фторида калия в реакции с
соляной кислотой.
Отметим, что добавление кислоты в реакционную смесь останавливает реакцию, так как протекают следующие процессы:
|

Исследование кинетики реакции (6) возможно провести, отбирая аликвоты из реакционной смеси и обрабатывая их кислотой (например, серной). При этом фиксируется состав реакционной смеси, достигнутый к определённому моменту времени. Так как одним из продуктов реакции оказывается хлорид-анион, то можно провести определить глубину превращения, оттитровав хлорид-ион раствором соли серебра.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление растворов
На аналитических весах взяли навеску пикрилхлорида 0,2533г и количественно перенесли в мерную колбу объёмом 100,0мл. Добавили приблизительно 35мл этилового спирта. Пикрилхлорид полностью растворился.
В мерную колбу на 50,0мл налили насыщенный раствор фторида калия в этиловом спирте (40мл, мерный цилиндр).
В отдельную мерную колбу ёмкостью 50,0мл налили около 35мл этилового спирта.
Поставили колбы в термостат – водяную баню, нагретую до температуры 40,2ºC.
Исследование кинетики нуклеофильного замещения
После 20мин термостатирования раствор фторида калия добавили к раствору пикрилхлорида и довели до метки этиловым спиртом. Включили секундомер. Из мерной колбы через определённые промежутки времени отбирали аликвоты 10,00мл и переносили в химический стакан на 50мл, куда предварительно наливали 10мл 0,2N серной кислоты. Временем отбора пробы считали тот момент, когда взятая аликвота была полностью добавлена к раствору кислоты в химическом стакане.
Время отбора проб (мин): 2,10; 10,73; 20,40; 29,93; 38,73; 48,32; 58,33.
Каждую пробу подвергали потенциометрическому титрованию 0,02N раствором нитрата серебра. По полученным точкам значение потенциала – добавленный объём титранта строили интегральную и дифференциальную кривые титрования и определяли точку эквивалентности.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.