|
D |
ΔD |
VPy, мкл |
V,мл |
V р-ра |
СPy |
1/ СPy |
1/ΔD |
|
0,63 |
0 |
0 |
0 |
0,003 |
0 |
||
|
0,72 |
0,09 |
10 |
0,01 |
0,003 |
0,040928 |
24,43299 |
11,11111 |
|
0,78 |
0,15 |
20 |
0,02 |
0,003 |
0,081857 |
12,21649 |
6,666667 |
|
0,82 |
0,19 |
30 |
0,03 |
0,003 |
0,122785 |
8,14433 |
5,263158 |
|
0,86 |
0,23 |
40 |
0,04 |
0,003 |
0,163713 |
6,108247 |
4,347826 |
|
0,9 |
0,27 |
50 |
0,05 |
0,003 |
0,204641 |
4,886598 |
3,703704 |
|
0,935 |
0,305 |
60 |
0,06 |
0,003 |
0,24557 |
4,072165 |
3,278689 |
|
0,94 |
0,31 |
70 |
0,07 |
0,003 |
0,286498 |
3,490427 |
3,225806 |
|
0,965 |
0,335 |
80 |
0,08 |
0,003 |
0,327426 |
3,054124 |
2,985075 |
|
1,1 |
0,47 |
100 |
0,1 |
0,003 |
0,409283 |
2,443299 |
2,12766 |
|
1,3 |
0,67 |
120 |
0,12 |
0,003 |
0,491139 |
2,036082 |
1,492537 |
|
1,6 |
0,97 |
150 |
0,15 |
0,003 |
0,613924 |
1,628866 |
1,030928 |
λ = 580 нм
T=322,4 K
|
D |
ΔD |
VPy, мкл |
V,мл |
V р-ра |
СPy |
1/ СPy |
1/ΔD |
|
0,68 |
0 |
0 |
0 |
0,003 |
0 |
||
|
0,755 |
0,075 |
10 |
0,01 |
0,003 |
0,040928 |
24,43299 |
13,33333 |
|
0,85 |
0,17 |
20 |
0,02 |
0,003 |
0,081857 |
12,21649 |
5,882353 |
|
0,89 |
0,21 |
30 |
0,03 |
0,003 |
0,122785 |
8,14433 |
4,761905 |
|
0,915 |
0,235 |
40 |
0,04 |
0,003 |
0,163713 |
6,108247 |
4,255319 |
|
0,955 |
0,275 |
50 |
0,05 |
0,003 |
0,204641 |
4,886598 |
3,636364 |
|
0,98 |
0,3 |
60 |
0,06 |
0,003 |
0,24557 |
4,072165 |
3,333333 |
|
0,982 |
0,302 |
70 |
0,07 |
0,003 |
0,286498 |
3,490427 |
3,311258 |
|
0,965 |
0,285 |
80 |
0,08 |
0,003 |
0,327426 |
3,054124 |
3,508772 |
|
1,03 |
0,35 |
100 |
0,1 |
0,003 |
0,409283 |
2,443299 |
2,857143 |
|
1,05 |
0,37 |
120 |
0,12 |
0,003 |
0,491139 |
2,036082 |
2,702703 |
|
1,1 |
0,42 |
150 |
0,15 |
0,003 |
0,613924 |
1,628866 |
2,380952 |
λ = 582 нм
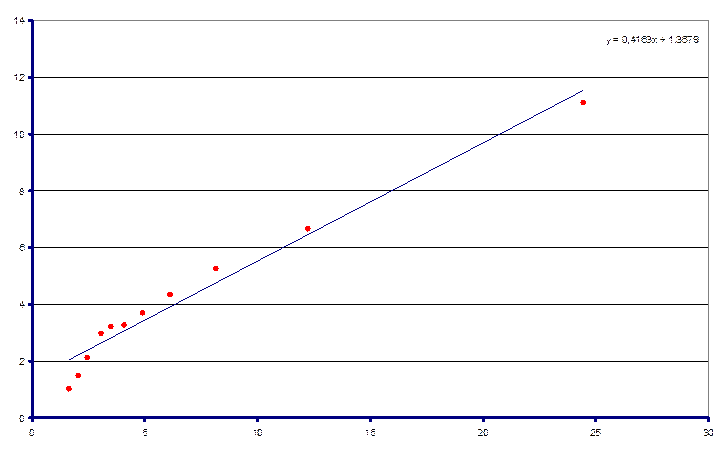
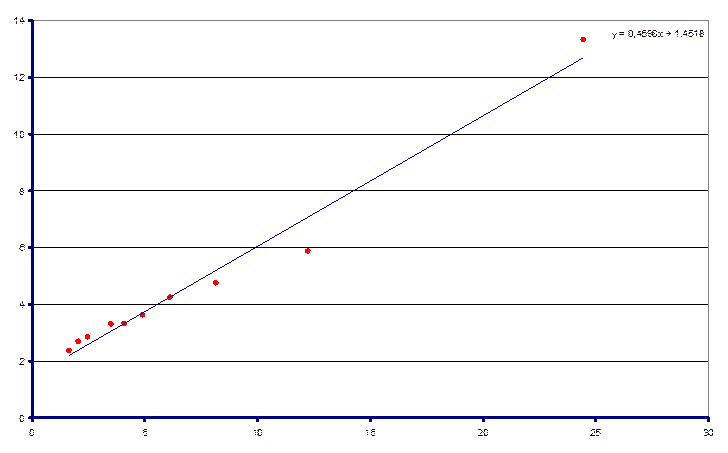
Согласно выражению (№) построили графики зависимость в координатах 1/ΔD - 1/ СPy при разных температурах. По экспериментальным точкам методом наименьших квадратов провели прямую и определили параметры А и В каждом случае. Нашли значение константы равновесия исследуемой реакции при каждой температуре и погрешность её определения по формуле
Т=297,1 К
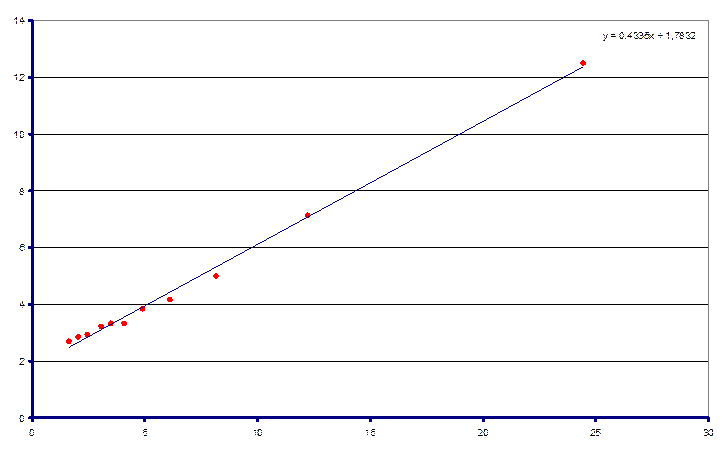
T = 313,2 K
T = 322,4 K
Согласно полученным данным заполнили таблицу:
|
K |
T |
lnK |
1/T |
|
4,11 |
297 |
1,413423 |
0,003367 |
|
3,286 |
313,1 |
1,189671 |
0,003194 |
|
3,16 |
322,4 |
1,150572 |
0,003102 |
Используя полученные значения констант равновесия построили график зависимость lnK от 1/T:
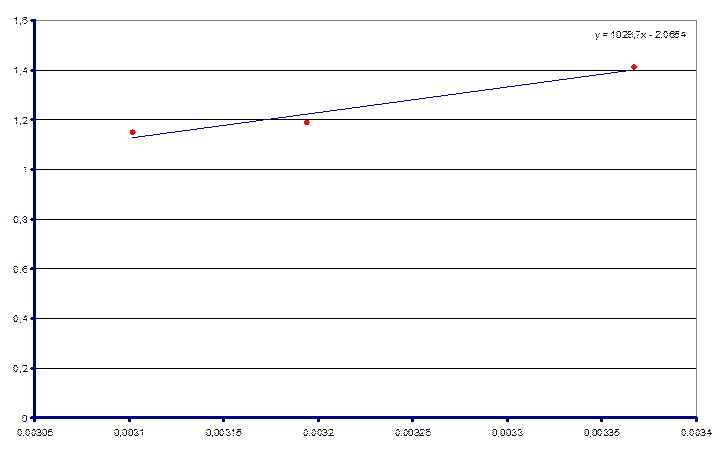
Проведя прямую по экспериментальным точкам определили энтальпию и энтропию реакции lnK = -ΔH/RT + ΔS/R
ΔrH = -8556,8 Дж/моль
ΔrS = -17,2 Дж/моль
Выводы
В результате проведенных измерений была получена зависимость константы равновесия реакции от температуры. В ходе работы проводились другие измерения, которые не согласовывались друг с другом наиболее вероятная причина – изменение состава раствора, в течение длительного времени, стоявшего в холодильнике. Результаты хорошо согласуются с результатами наших коллег, проводивших измерения, используя чистый хлороформ. Константа равновесия в чистом хлороформе должна быть ниже из-за возможной координации самого растворителя. Введение же толуола уменьшает концентрацию хлороформа и, тем самым увеличивает способность координации пиридина.
Использованная литература:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.