





ВАРИАНТ 20
Задача №20: При образовании 1120мл (при стандартных условиях) оксида серы(IV) из простых веществ выделилось 14,8 кДж. Рассчитать энтальпию образования оксида серы (IV).
Решение:
Реакция горения серы в кислороде является экзотермической реакцией и выражается уравнением
S(тв) +O2(г) =SO2(г)
Энтальпия образования сложного вещества принимается равной энтальпии реакции образования одного моля этого вещества из простых веществ.
Термохимическое уравнение запишется
S(тв) +O2(г) =SO2(г) ∆H < 0
Как видно из термохимического уравнения для образования одного моля оксида серы необходимо израсходовать 1 моль серы. Один грамм-моль серы имеет массу 32 г. (см. Периодическую систему Д.И.Менделеева).
Из стереохимического уравнения видно, что на 1 моль серы приходится 1 моль оксида серы (IV). Следовательно, найдем массу серы, израсходованную на образование 1120 мл (1,120л) оксида серы (IV).
Для этого сначала необходимо воспользоваться формулой плотности вещества:
d = m/V,
где m – масса вещества, V – объем вещества.
Из формулы выразим массу:
m = d x V
Из табличных данных, плотность оксида серы (IV) равна 2,927 г/л. Значит, масса 1,120 л оксида серы (IV) составляет 3,278 г.
Теперь нужно найти количество вещества оксида серы (IV) в 3,278 г. По формуле
n=m/М
находим количество вещества оксида серы (IV). Оно составляет 0,05 моль. Следовательно, исходя из уравнения реакции, реальное количество вещества серы равно 0,05 моль.
Найдем массу серы, ушедшей на реакцию: 0,05 моль х 32 г/моль=1,6 г.
Составим соотношение:
при взаимодействии 1,6 г серы выделилось (ΔΗ реакции) 14,8 кДж.
![]() при соединении 32 г алюминия ΔΗ реакции равна X кДж
при соединении 32 г алюминия ΔΗ реакции равна X кДж
X
(тепловой эффект реакции) = 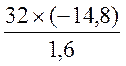 = –296 кДж.
= –296 кДж.
Ответ. Энтальпия образования оксида серы (IV) равна –296 кДж/моль, т.к. это тепловой эффект образования одного моля этого вещества из простых веществ.
Задача №40:Указать возможность самопроизвольного протекания процесса при стандартных условиях
H2S(г) + 2O2 (г) = SO3 (г) + H2O(г).
Решение:
Значение энергии Гиббса является критерием самопроизвольности протекания химических реакций в прямом или обратном направлении:
при ΔG < 0 /реально меньше –2/ реакция идет самопроизвольно в прямом направлении.
Из термохимического уравнения следует, что в реакции участвуют и образуются вещества в количестве:
H2S(г) + 2O2 (г) = SO3 (г) + H2O(г).
Число молей: 1 2 1 1
Из таблицы термодинамических функций (см. табл. 2) находим, что энергия Гиббса образования веществ в стандартных условиях равна
ΔG°298 кДж/моль -33,50 0 -371,17 -228,61
Используя уравнение расчета энтальпии реакции
ΔG°298 реакции = [1· ΔG° H2O+1· ΔG° SO3] – [1 · ΔG°O2 + 1 · ΔG°H2S],
находим
ΔG°298 реакции = [1 · (-228,61) + 1· (-371,17 )] – [1· (-33,50) + 1· (0)] = -566,28кДж/моль
Ответ.Энергия Гиббса реакции в стандартных условиях меньше нуля. Это указывает, что данная реакция самопроизвольно идет в прямом направлении.
Задача №60: Указать направление смещения равновесия для реакции: а) при увеличении концентрации исходных веществ, б) при уменьшении температуры системы, в) при увеличении давления в системе. Ответ обосновать. Написать выражение константы равновесия реакции через равновесные концентрации.
2CL2 (г) + 2H2O (г) <=>2HCL (г) + O2(г) ∆ H O < 0
Ответ:
Так как ∆ H O < 0, то реакция экзотермическая. Значит, по принципу Ле Шателье:
а) при увеличении концентрации исходных веществ равновесие в реакции будет сдвигаться вправо (в сторону прямой реакции), т.к. при повышении концентрации одного из веществ (исходных или продуктов) равновесие сдвигается в направлении расхода этого вещества и наоборот.
б) при уменьшении температуры системы равновесие в реакции будет сдвигаться вправо (в сторону прямой реакции), т.к. при понижении температуры системы химическое равновесие смещается в направлении экзотермической реакции (реакции, идущей с выделением тепла) В нашем случае прямая реакция – экзотермическая.
в) при увеличении давления в системе равновесие в реакции будет сдвигаться вправо (в сторону прямой реакции), т.к.при повышении давления в системе равновесие смещается в направлении образования веществ (реагентов или продуктов) с меньшим объемом (меньшим числом молей веществ в газообразном состоянии).
При состоянии равновесия, когда скорости прямой и обратной реакций равны
(Vпр = Vобр ) или Кпр▪ [CL2]2▪ [H2O] 2 = Кобр▪ [HCL]2▪ [O2]
константа равновесия через равновесные концентрации запишется
Кравн. = Кпр / Кобр = [HCL]2▪ [O2] /[CL2]2▪ [H2O] 2
Задача №80: Сколько неспаренных электронов содержится в электронной оболочке атомов элементов вольфрама и криптона. Ответ обосновать.
Решение:
Вольфрам – элемент шестой группы б-подгруппы 6 периода периодической системы элементов Д.И. Менделеева.
Атомный номер 74.
Электронная формула вольфрама:
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4
Так как последний d-уровень заполнен меньше, чем на половину, у вольфрама в электронной оболочке содержится 4 неспаренных электрона (в соответствии с принципом Паули).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.