T=313 К
|
D |
ΔD |
VPy, Мкл |
VPy, Мл |
Vр-ра мл |
CPy |
1/CPy |
1/ΔD |
|
0,843 |
0 |
0 |
0 |
0,003 |
0 |
||
|
0,897 |
0,054 |
10 |
0,01 |
0,003 |
0,0409 |
24,4330 |
18,5185 |
|
0,993 |
0,150 |
20 |
0,02 |
0,003 |
0,0819 |
12,2165 |
6,6667 |
|
0,990 |
0,147 |
30 |
0,03 |
0,003 |
0,1228 |
8,1443 |
6,8027 |
|
1,098 |
0,255 |
40 |
0,04 |
0,003 |
0,1637 |
6,1082 |
3,9216 |
|
1,125 |
0,282 |
50 |
0,05 |
0,003 |
0,2046 |
4,8866 |
3,5461 |
|
1,140 |
0,297 |
60 |
0,06 |
0,003 |
0,2456 |
4,0722 |
3,3670 |
|
1,179 |
0,336 |
70 |
0,07 |
0,003 |
0,2865 |
3,4904 |
2,9762 |
|
1,209 |
0,366 |
80 |
0,08 |
0,003 |
0,3274 |
3,0541 |
2,7322 |
|
1,219 |
0,376 |
100 |
0,1 |
0,003 |
0,4093 |
2,4433 |
2,6596 |
|
1,251 |
0,408 |
120 |
0,12 |
0,003 |
0,4911 |
2,0361 |
2,4510 |
|
1,260 |
0,417 |
150 |
0,15 |
0,003 |
0,6139 |
1,6289 |
2,3981 |
Обсуждение результатов.
На полученных спектрах наблюдается изобестическая точка, поскольку ![]() = const.
= const.
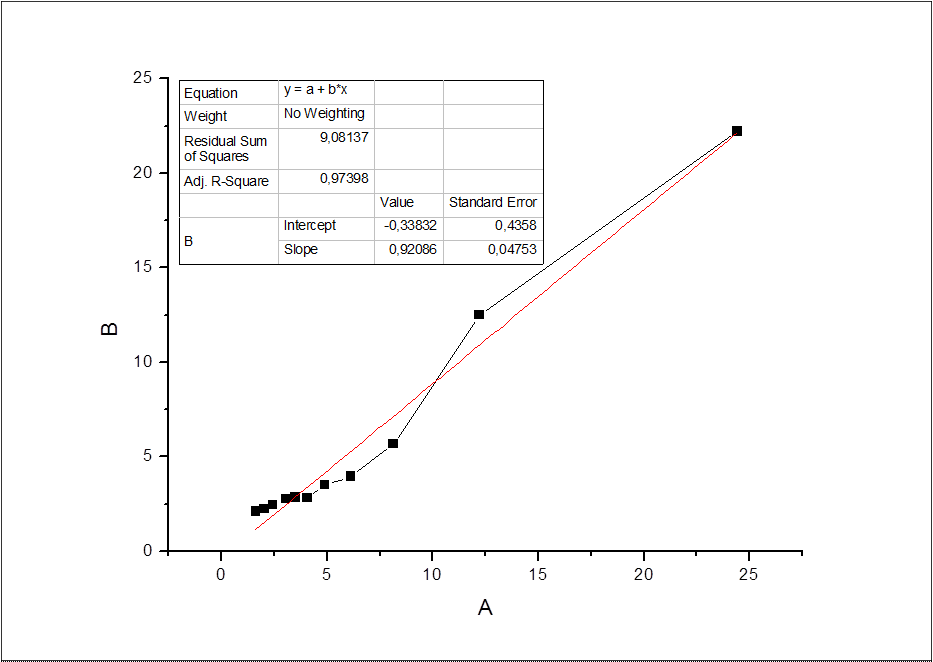
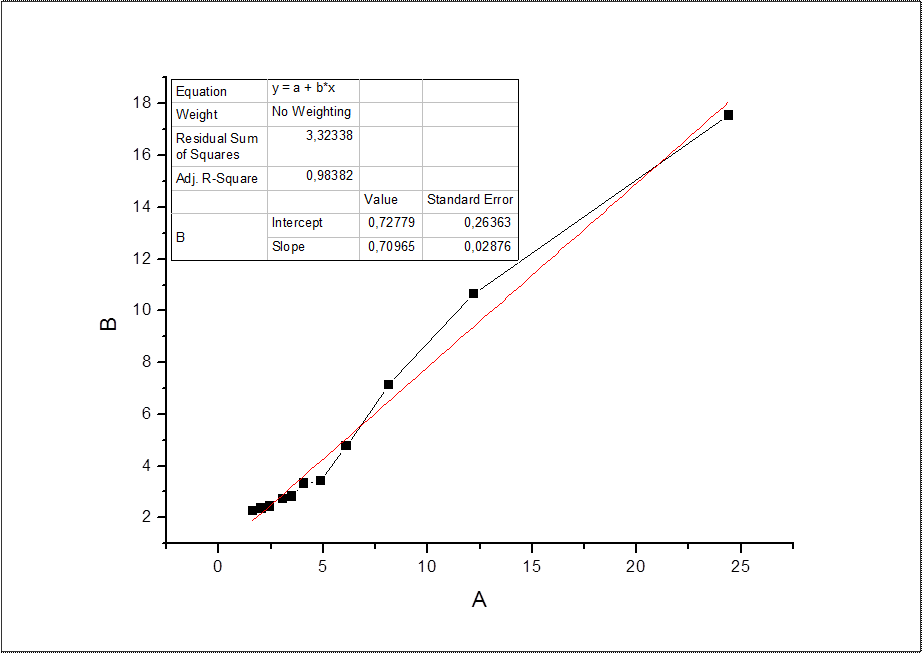
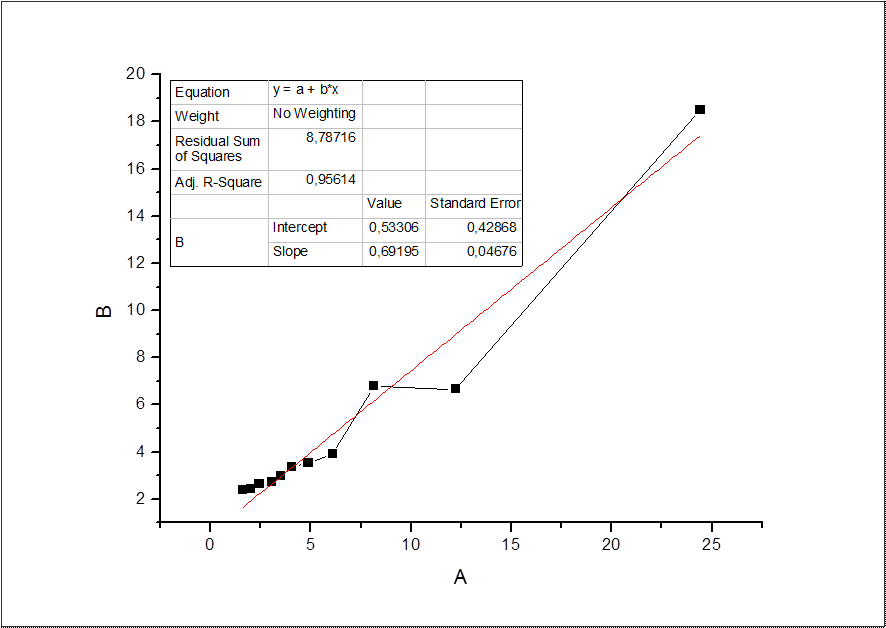
На основании полученных данных были построены и обработаны методом наименьших квадратов графики зависимости 1/ ΔD от 1/CPy .
Отношение отрезка, отсекаемого прямой на оси ординат, к тангенсу угла наклона прямой дает искомое значение константы K.
K (298) = 0,367396
K (303) = 1,776207
K (308) = 1,025561
К (313) = 0,770374
Из этих данных видно, что константа с увеличением температуры уменьшается. Однако значение при T=298 К выпадает, что может говорить об ошибках, допущенных при проведении эксперимента.
Погрешность измерения константы находим по формуле δK = [ (δА/A)2+(δB/B)2] -1/2
На графиках приведены вышеуказанные зависимости и полученные значения.
 T=298 К
T=298 К
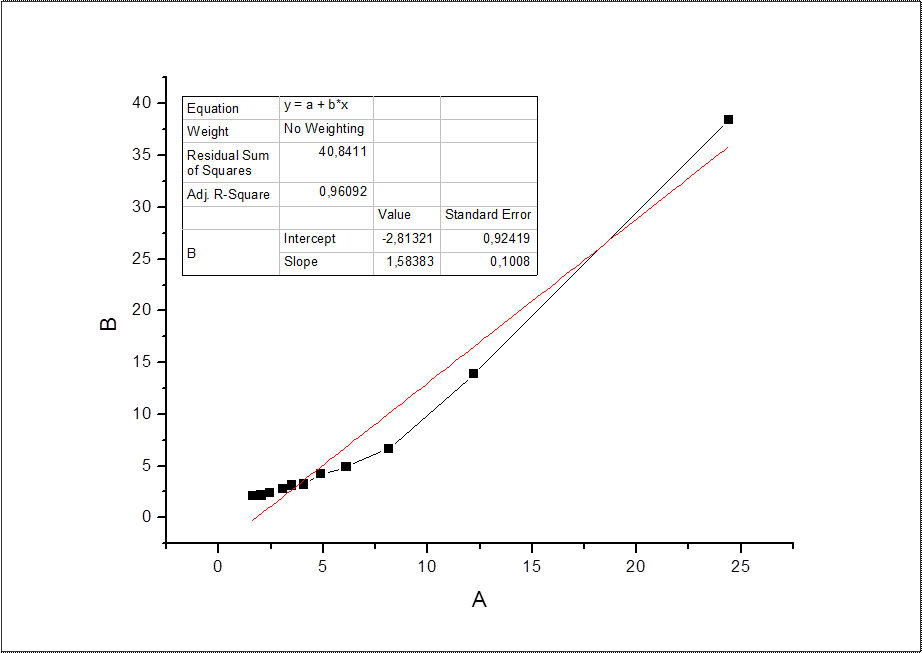
 T=303 К
T=303 К
T=308 К
 T=313 К
T=313 К
Значения термодинамических параметров находим по уравнению изобары Вант-Гоффа:
RlnK = -ΔHo / T + ΔSo
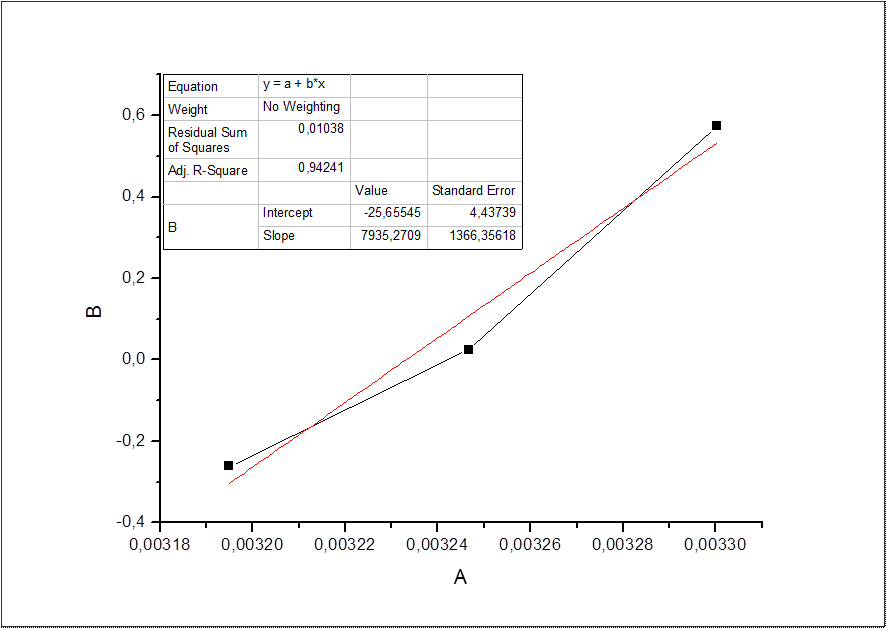
То есть, для логарифмической зависимости константы равновесия от величины, обратной температуре, тангенс угла наклона касательной равен ΔHo , а отрезок, отсекаемый на оси ординат ΔSo. На основании полученных результатов строим график зависимости и вычисляем термодинамические величины.
ΔrHo = -65,9 кДж/моль
ΔrSo = -213,3 Дж/моль/К
Погрешности измерения энтропии и энтальпии составили 1366 Дж/моль и 4,437 Дж/моль/К соответственно.
Данные вычисления были выполнены в предположении, что энтальпия и энтропия не зависят от температуры в исследуемом интервале температур.
Выводы.
1). Итогом работы стала полученная зависимость константы равновесия реакции от температуры.
2). Наличие изобестической точки на всех снятых спектрах свидетельствует о правильности приготовления исследуемых растворов.
3). Константа равновесия имеет обратну зависимость от темепературы и понижается в чистом хлороформе из-за возможной координации самого растворителя. Введение же толуола уменьшает концентрацию хлороформа и, тем самым, увеличивает способность координации пиридина.
4). Были рассчитаны термодинамические параметры ΔrHo = -65,9 кДж/моль
ΔrSo = -213,3 Дж/моль/К
5). Для более точного определения термодинамических характеристик нужно делать большее количество температурных точек. Причем лучше использовать температуры ниже 50оС, т.к. хлороформ кипит при Т= 61,3оС, что может привести к значительному ухудшению результатов эксперимента.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.