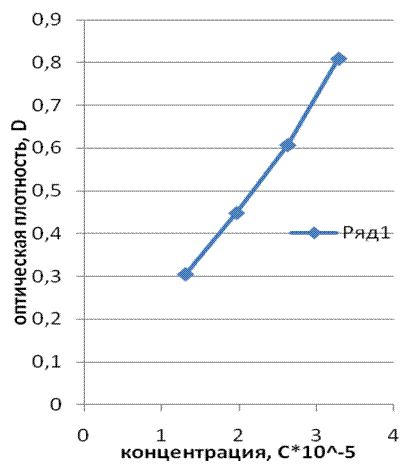
b. Снимают спектры поглощения растворов № 2-5, 7, 8. Определяют оптические плотности Dλ протонированной и депротонированной форм индикатора на рабочих длинах волн. Проверяют выполнение закона Бугера-Ламберта-Бэра. Строят графики зависимости Dλ от концентрации индикатора для кислых и щелочных растворов (см. рис. 1). Рассчитывают коэффициент экстинкции для каждой формы индикатора ε и среднеквадратичную погрешность его определения σn. Результаты заносят в табл.1.
По формуле:
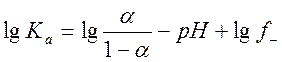
рассчитывают значение константы диссоциации индикатора. Результаты экспериментов и расчетов сводят в табл.2. Полученное значение Ка сравнивают со справочными данными.
Обработка результатов.
Табл.1
Определение коэффициентов экстинкции протонированной и депротонированной форм метилового оранжевого
|
Форма индикатора |
Конц. индикатора С, М |
Длина волны l, нм |
Оптическая плотность, Dλ |
Коэффициент экстинкции e, М-1×см-1 |
e ср±sn |
|
Протонир. НА |
2, 63*10-5 |
508 |
1.058 |
40228 |
43786±7185 |
|
1,97*10-5 |
0,786 |
39898 |
|||
|
1,31*10-5 |
0,530 |
40458 |
|||
|
6,58*10-6 |
0,359 |
54559 |
|||
|
Депротонир. А- |
3,29*10-5 |
464 |
0,810 |
24620 |
23472±800 |
|
2, 63*10-5 |
0,608 |
23118 |
|||
|
1,97*10-5 |
0,449 |
22792 |
|||
|
1,31*10-5 |
0,306 |
23359 |
Зависимость, характеризующую ослабление света веществом, можно представить в логарифмическом виде
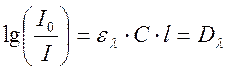
где I0 и I- интенсивность прошедшего и падающего на образец света; С- молярная концентрация; l- длина оптического пути; ελ- коэффициент пропорциональности, называемый коэффициентом экстинкции вещества.
Таким образом закон Бугера-Ламберта-Бера представляет наличие линейной зависимости между оптической плотностью вещества и его молярной концентрацией.
Зная значения Dкисл и Dщел, можно найти значения коэффициентов экстинкции обеих форм:
εНА= Dкисл /(C0*l); εA-= Dщел/(C0*l)
Если все измерения проводятся в кювете с одинаковой толщиной оптического слоя, то степень диссоциации кислоты НА можно записать следующим образом:
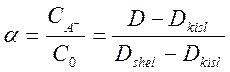
При измерениях в буферных растворах с известным значением рН константа диссоциации записывается в виде
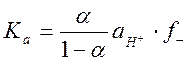
где коэффициент активности аниона кислотного остатка рассчитывается по формуле Дебая-Хюккеля:
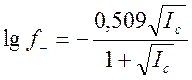
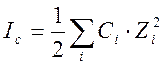
где Ic-ионная сила раствора; Ci и Zi – молярная концентрация и заряд иона.
Итоговой формулой для расчета константы диссоциации одноосновной кислоты в буферном растворе:
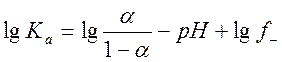
Табл.2
Расчет константы диссоциации метилового оранжевого
|
№ |
pH |
Iс, M |
lg f- |
Dλ |
aλ |
lg{α/(1-α)} |
lg Ka |
Ka |
|||||
|
λ1=508 |
λ2=464 |
λ1 |
λ2 |
λ1 |
λ2 |
λ1 |
λ2 |
λ1 |
λ2 |
||||
|
1 |
1 |
10-1 |
-0,12 |
1,058 |
0,476 |
0 |
0 |
||||||
|
6 |
13 |
10-1 |
-0,12 |
0,368 |
0,608 |
1 |
1 |
||||||
|
9 |
3,9 |
2*10-2 |
-0,06 |
0,489 |
0,595 |
0,82 |
0,84 |
0,66 |
0,72 |
-3,3 |
-3,3 |
5,01*10-4 |
5,01*10-4 |
|
10 |
3,7 |
1,3*10-2 |
-0,05 |
0,551 |
0,560 |
0,73 |
0,68 |
0,43 |
0,33 |
-3,3 |
-3,5 |
5,01*10-4 |
3,16*10-4 |
|
11 |
3,5 |
8*10-3 |
-0.04 |
0,673 |
0,546 |
0,56 |
0,53 |
0,11 |
0,05 |
-3,4 |
-3,5 |
3,98*10-4 |
3,16*10-4 |
|
Среднее значение |
-3,4 |
4,22*10-4 |
|||||||||||
|
Погрешность определения |
±0,06 |
±0,91*10-4 |
|||||||||||
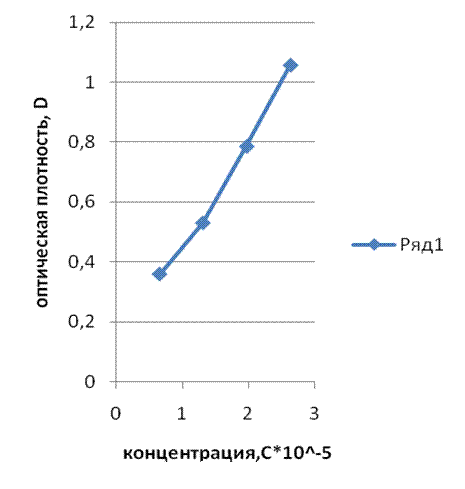
Проверка закона Бугера-Ламберта-Бера – линейной зависимости оптической плотности от концентрации и толщины кюветы.
Выводы
1. Закон Бугера-Ламберта-Бэра для наших растворов выполняется, то видно из графиков зависимости D-C.
2. Полученное значение константы диссоциации не совпадает со справочным значением Ка= 2*10-4. Это может быть связано с тем, что в справочной литературе приведены данные при 25°С. В лаборатории во время проведения эксперимента было 16°С. Также неточность результата может быть обусловлена случайными и систематическими погрешностями.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.