РЯД НАПРЯЖЕНИЙ И ЭЛЕКТРОХИМИЧЕСКИЙ РЯД
Ряд напряжений - это строго упорядоченное расположение стандартных потенциалов для всех металлов. Более отрицательные значения потенциалов соответствуют более реакционноспособным металлам (см. табл. 1).
Например, в соответствии с рядом напряжений олово благороднее железа.
Fe2+ +Sn-> Sn2+ + Fe
Коррозия двух контактирующих поверхностей зависит не только от того, насколько они отстоят друг от друга в электрохимическом ряду, но также и от отношения площадей их поверхностей.
Таблица I
Стандартные потенциалы реакций
|
|
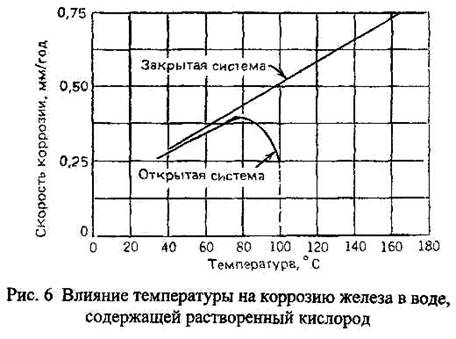
ВЛИЯНИЕ ТЕМПЕРАТУРЫ И рН НА СКОРОСТЬ КОРРОЗИИ
Если скорость коррозии контролируется диффузией кислорода, то для данной концентрации кислорода скорость реакции приблизительно удваивается при повышении температуры на каждые 300 °С. В открытом сосуде, из которого кислород может улетучиваться, скорость коррозии увеличивается с ростом температуры до 80 °С, а затем падает до очень низкого значения при закипании воды В закрытой системе кислород не может улетучиваться, поэтому скорость коррозии продолжает расти с повышением температуры до тех пор, пока весь кислород не будет израсходован (рис. 6).
В пределах рН= 4-10 скорость коррозии определяется только скоростью диффузии кислорода к поверхности металла. Независимо от величины рН воды в указанных пределах поверхность железа всегда контактирует со щелочными растворами
В кислой среде (рН < 4а) пленка оксида железа растворяется, и значение рН на поверхности железа снижается. Увеличение щелочности среды (рН > 10) вызывает
возрастание рН на поверхности железа. Скорость коррозии при этом уменьшается, так как железо пассивируется.
 |
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
При изучении потерь от коррозии используется весовой метод, позволяющий выдержать исследуемый образец в коррозионно-активном водном растворе в течение 7 суток. Для этой цели студенту предстоит получить у преподавателя два образца сплавов: один стальной образец и второй образец цветного металла. Далее проделываются следующие операции:
1) полученные образцы маркируются;
2) после этого делается запись в рабочем журнале;
3) образец подвергается шлифованию;
4) шлиф после травления с помощью металлографического микроскопа изучается с целью выявления микроструктуры, фотографируется и изготавливается микрофотография. Далее шлиф взвешивают;
5) производится измерение твердости по Бринелю;
6) приготавливается раствор для изучения потерь от коррозии;
7) шлиф погружается в раствор и оставляется в нем на 7 суток;
8) по истечении этого срока шлиф извлекается из раствора, промывается, сушится и взвешивается;
9) с помощью специальных реактивов с поверхности шлифа снимается коррозионный слой, измеряется твердость по Бринелю и шлиф фотографируется;
10) подсчитываются потери от коррозии, скорость коррозии в Г/мгсут и мм/год;
11) составляется подробный отчет.
 Таблица 2 Размеры образца
Таблица 2 Размеры образца
|
№ образца |
Марка |
H,мм |
h,мм |
R,мм |
r,мм |
S,мм |
|
1 |
Сталь 45 |
19 |
4,5 |
2,4 |
1 |
367,427 |
|
2 |
Латунь |
20 |
5 |
2,5 |
1 |
404,375 |
Таблица 3
Результаты испытаний образцов на коррозию в 3-х % растворе NaCl
|
№ образца |
Материал |
Масса образца, г |
Убыль |
Потери от коррозии, г/м 2сут |
Скорость коррозии, мм/год |
|
|
до испытания |
после испытания |
|||||
|
1 |
Сталь 45 |
2,76554 |
2,72595 |
0,03959 |
||
|
2 |
Латунь |
3,13047 |
3,12915 |
0,00132 |
||
УРАВНЕНИЯ ДЛЯ РАСЧЕТА ПОТЕРЬ ОТ КОРРОЗИИ И СКОРОСТИ КОРРОЗИИ
1. Потери от коррозии определяются из уравнения
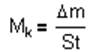 где Мк - потери
металла от коррозии, г/м сут;
где Мк - потери
металла от коррозии, г/м сут;
∆m - изменение массы образца до и после испытаний, г;
S - площадь поверхности образца, см2;
t - время испытания на коррозию, сут., (принимается по заданию преподавателя).
Мk1 = 0,03959/367,427*7 = 1,53*10-5 гр/мм2 сут
Мk2 = 0,00132/404,375*7 = 0,04*10-5 гр/мм2 сут
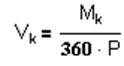 2. Скорость коррозии определяется по уравнению:
2. Скорость коррозии определяется по уравнению:
где Р - плотность 3%-ного раствора NaCl при 20 °С (принимается Р = 1,02 г/см3);
Vk - скорость коррозии, мм/год.
Vk1 = 0, 0416 мм/сут
Vk2 = 0, 001 мм/сут
Вывод: в ходе данной работы я изучил потери металла от коррозии в различных средах путем измерения механических свойств образцов до и после выдержки их в агрессивных средах (водных растворах в течение 3-7 суток), а также с помощью оптических микроскопов я определил структуру сплавов в процессе коррозионного разрушения и до него.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.