Цель работы: ознакомление студентов с термодинамическими свойствами рабочих тел на примере воды и водяного пара. Освоение методики опытного определения зависимости давления от температуры в двухфазной области в процессе изохорного нагревания и способа нахождения удельной теплоты парообразования.
Краткие сведения из теории: Всякое вещество может находиться в разных фазах, которые представляют собой различные агрегатные состояния вещества. Каждая из фаз представляет собой однородную систему с одинаковыми физическими свойствами во всех ее частях. Характерной особенностью фазы является наличие границ, отделяющих данную фазу от соприкасающихся с ней других фаз.
Вещество может переходить из одной фазы в другую, и этот переход называется фазовым переходом или фазовым превращением. Переход из твердой или жидкой фазы в газообразную называется испарением, а обратный переход — конденсацией. Переход из твердой фазы в жидкую называется плавлением, а обратный переход — затвердеванием или кристаллизацией. Переход из твердой фазы в газообразную называется сублимацией, а обратный переход - десублимацией. Равновесное сосуществование нескольких соприкасающихся между собой различных фаз вещества называется фазовым равновесием.
Существование метастабильных состояний вещества обусловлено устойчивостью каждой фазы по обе стороны кривой фазового равновесия. И жидкое состояние, будучи вполне устойчивым выше кривой равновесия, будет достаточно устойчивым и несколько ниже этой кривой. Аналогично газообразное состояние, являясь вполне устойчивым ниже кривой фазового равновесия, будет обладать некоторой устойчивостью и выше этой кривой. Поэтому жидкое состояние вещества может встречаться ниже кривой фазового равновесия в виде перегретой жидкости, а газообразное — выше этой кривой в виде переохлажденного или насыщенного пара.
Однако жидкое состояние вещества ниже кривой будет менее устойчивым по сравнению с газообразным из-за нарушения равенства химических потенциалов жидкости и пара и рано или поздно перейдет в газообразное. Также и газообразное состояние выше кривой менее устойчиво, чем жидкое.
Кривая равновесия жидкой и газообразной фаз заканчивается в кри-.тической точке . Параметры вещества, соответствующие этому состоянию, называются критическими. Для воды они составляют: ркр = 22,115 МПа; Ткр = 374,15 °С; гкр = 0,00326 м3/кг. При температуре выше критической сжижение газа (пара), то есть превращение его в жидкость, невозможно. При этих условиях между жидким и газообразным состоянием вещества нет какого-либо принципиального различия — жидкость и газ различаются лишь количественно, но не качественно.
Существуют также кривые фазового равновесия твердой и жидкой фаз, твердой и газообразной фаз. Все три кривые фазового равновесия изображены на диаграмме, представленной на рисунке 2.
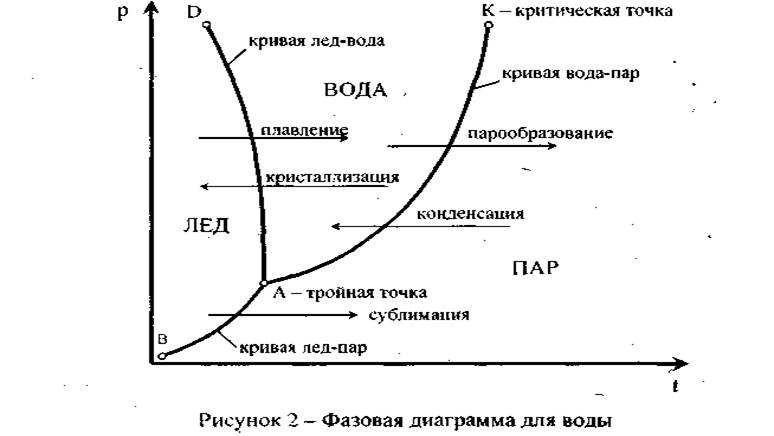
Кривые фазового равновесия каждых двух из трех фаз пересекаются. В результате этого вся плоскость диаграммы р-Т оказывается разбитой на области кристаллической, жидкой и газообразной фаз. Состояния, в которых находятся в равновесии три различных фазы вещества, получили название тройных точек. Равновесное существование более чем трех фаз веществ невозможно.
Переход вещества из одной фазы в другую сопровождается поглощением или выделением определенного количества теплоты. Количество теплоты, поглощаемое (или выделяемое) при равновесном изотермическом переходе 1 кг вещества из одной фазы в другую, называется удельной теплотой фазового перехода и обозначается г.
Изменение давления вдоль кривой равновесия фаз, или, что то же самое, зависимость равновесного давления обеих фаз от температуры определяется, по формуле Клапейрона-Клаузиуса
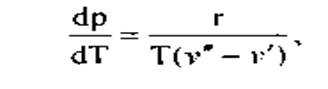
где dp/dT— производная от давления по температуре, взятая по кривой фазового равновесия;
r - удельная теплота фазового перехода;
v'- удельный объем воды при температуре кипения;
v" — удельный объем сухого пара.
Лабораторная установка обеспечивает исследование кривой насыщения водяного пара только до избыточного давления 0,3 МПа. Однако и в этих условиях можно не только накопить совокупность соответствующих значений р и Т, но и сравнительно простым и достаточно точным способом найти значения удельной теплоты парообразования – конденсации r .
В самом деле, при малых давлениях удельные объемы кипящей воды v' пренебрежимо малы в сравнении с соответствующими значениями удельных объемов сухого пара v".
Исходя из этого, упростим уравнение Клапейрона-Клаузиуса условием v' = 0. Тогда
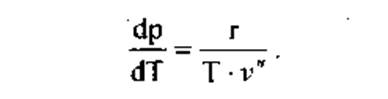 (1)
(1)
Если так или иначе оказываются известными функция р = f(t), аппроксимирующая кривую насыщения, и совокупность значений v", то-с помощью этого уравнения можно найти соответствующие значения удельной теплоты парообразования - конденсации.
При малых давлениях:
— удельную теплоту парообразования - конденсации будем считать линейной функцией температуры вида (кДж/кг):
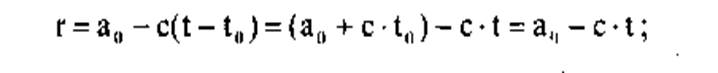 (2)
(2)
- состояние сухого пара опишем уравнением, близким к уравнению состояния идеального газа (кДж/[кг-К]):
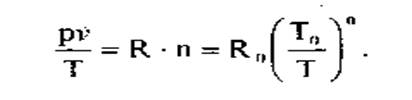 (3)
(3)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.