ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ АТОМОВ.
СОСТОЯНИЯ АТОМА И ИХ СПЕКТРОСКОПИЧЕСКОЕ ОБОЗНАЧЕНИЕ
В квантовой
механике состояние электрона в поле ядра характеризуется четырьмя квантовыми
числами: главным (![]() 1, 2,
3, …), орбитальным (
1, 2,
3, …), орбитальным (![]() 0, 1, 2, …,
0, 1, 2, …, ![]() ), магнитным (
), магнитным (![]() 0,
0, ![]() ) и спиновым
(
) и спиновым
(![]() ).Одноэлектронная собственная функция
атома
).Одноэлектронная собственная функция
атома ![]() носит название атомной орбитали
(АО).
носит название атомной орбитали
(АО).
Совокупность
атомных орбиталей (квантовых состояний), соответствующих определенному значению
главного квантового числа ![]() , образует так
называемый электронный слой, который обозначается буквой или цифрой:
, образует так
называемый электронный слой, который обозначается буквой или цифрой:
|
Главное квантовое число, |
1 |
2 |
3 |
4 |
5 |
… |
Обозначение слоя |
K |
L |
M |
N |
O |
… |
Совокупность
атомных орбиталей, соответствующих определенному значению орбитального
квантового числа ![]() , формирует так называемую электронную
оболочку, обозначаемую следующим образом:
, формирует так называемую электронную
оболочку, обозначаемую следующим образом:
|
Орбитальное квантовое число, |
0 |
1 |
2 |
3 |
4 |
… |
|
Обозначение оболочки |
|
|
|
|
|
… |
Число ![]() состояний, формирующих электронную
оболочку с заданным
состояний, формирующих электронную
оболочку с заданным ![]() , можно подсчитать по формуле
, можно подсчитать по формуле
![]() ,
,
Количество
квантовых состояний ![]() , формирующих электронный слой:
, формирующих электронный слой:
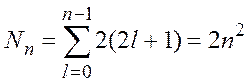 .
.
Одноэлектронному
атому при заданном значении ![]() соответствует
определенной величины энергия (
соответствует
определенной величины энергия (![]() -й энергетический
уровень). Данное значение энергии относится к
-й энергетический
уровень). Данное значение энергии относится к ![]() квантовых
состояний (атомных орбиталей). Энергетический уровень называется в таком случае
вырожденным, а
квантовых
состояний (атомных орбиталей). Энергетический уровень называется в таком случае
вырожденным, а ![]() является кратностью
вырождения
является кратностью
вырождения ![]() -го уровня.
-го уровня.
Исследование
спектров показало, что в многоэлектронных атомах энергия электронов зависит не
только от главного квантового числа ![]() , но и от орбитального
квантового числа
, но и от орбитального
квантового числа ![]() , то есть происходит снятие
вырождения по
, то есть происходит снятие
вырождения по ![]() . Снятие вырождения по
. Снятие вырождения по ![]() в многоэлектронных атомах является
следствием взаимодействия между электронами.
в многоэлектронных атомах является
следствием взаимодействия между электронами.
Основными принципами, лежащими в основе заполнения АО, являются следующие:
1. В каждом квантовом состоянии не может быть более одного электрона (принцип Паули);
2. При дополнении электронной оболочки каждым последующим электроном получаемая при этом система частиц (атом) должна обладать минимальной энергией.
Правило
Клечковского гласит: заполнение оболочек электронами происходит в порядке
возрастания суммы ![]() , причем состояния с одинаковым
значением этой суммы заполняются, как правило, в порядке возрастания
, причем состояния с одинаковым
значением этой суммы заполняются, как правило, в порядке возрастания ![]() .
.
Эмпирическое правило Хунда: порядок заполнения состояний данной оболочки электронами таков, что их суммарный спин имеет максимальное из возможных значение.
Электронная конфигурация
– это запись, указывающая количество электронов на каждой электронной оболочке
атома в порядке возрастания их энергии. Например, электронная конфигурация
атома натрия (![]() ) в нормальном состоянии имеет
вид
) в нормальном состоянии имеет
вид ![]() .
.
Если
спин-орбитальное взаимодействие пренебрежимо мало, для определения
полного момента атома используется связь ![]() (нормальная,
или связь Рассела-Саундерса). В этом случае интегралами движения, то
есть физическими величинами, характеризующими стационарное состояние атома,
являются: суммарный орбитальный момент атома
(нормальная,
или связь Рассела-Саундерса). В этом случае интегралами движения, то
есть физическими величинами, характеризующими стационарное состояние атома,
являются: суммарный орбитальный момент атома ![]() ,
суммарный спиновый момент атома
,
суммарный спиновый момент атома ![]() и их проекции
и их проекции ![]() и
и ![]() .
Энергия атома в этом приближении зависит от значений квантовых чисел
.
Энергия атома в этом приближении зависит от значений квантовых чисел ![]() и
и ![]() .
.
Суммарный орбитальный момент атома равен:
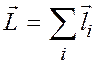 ,
,
где ![]() - орбитальный момент
- орбитальный момент ![]() -го электрона
-го электрона
Суммарный спиновый момент атома определяется выражением
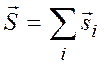 ,
,
Полный
момент атома ![]() равен:
равен:
![]() ,
,
. Правило квантования ![]() имеет вид:
имеет вид:
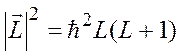 .
.
Квантовые состояния в зависимости
от значения числа ![]() принято обозначать буквами:
принято обозначать буквами:
|
Значение квантового числа |
0 |
1 |
2 |
3 |
4 |
… |
|
Обозначение состояния |
|
|
|
|
|
… |
Проекция ![]() суммарного орбитального момента на ось
суммарного орбитального момента на ось ![]() квантуется по правилу
квантуется по правилу
![]() .
.
При заданном ![]() квантовое число
квантовое число ![]() может
иметь следующие значения:
может
иметь следующие значения:
![]() ,
,
то есть каждому значению ![]() соответствует
соответствует ![]() значений
квантового числа
значений
квантового числа ![]() .
.
Квадрат модуля спинового момента квантуется:
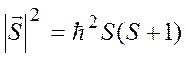 .
.
Квантовое число ![]() меняется через единицу и принимает либо
целые (для атомов с четным числом электронов), либо полуцелые (в случае
нечетного числа электронов в атоме) значения.
меняется через единицу и принимает либо
целые (для атомов с четным числом электронов), либо полуцелые (в случае
нечетного числа электронов в атоме) значения.
Проекция ![]() спинового момента атома квантуется по
правилу
спинового момента атома квантуется по
правилу
![]() ,
,
при этом квантовое число ![]() может быть равным
может быть равным
![]()
(всего ![]() значений).
значений).
Для квадрата полного момента имеет место квантование
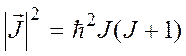 .
.
Возможные значения квантового
числа ![]() определяются:
определяются:
![]() .
.
Проекция ![]() полного момента атома на выделенное
направление квантуется:
полного момента атома на выделенное
направление квантуется:
![]() ,
,
а квантовое число ![]() принимает
принимает ![]() значений:
значений:
![]() .
.
Если спин-орбитальное взаимодействие велико, для определения полного момента сложного атома используется j-j связь:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.