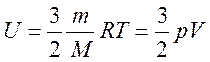 .
.
Способы изменения внутренней энергии: теплопередача (микроскопический способ), совершение механической работы (макроскопический способ).
Теплообмен (теплопередача) – процесс передачи энергии от одного тела к другому без совершения работы. Теплообмен происходит между телами, имеющими различную температуру, при этом энергия передается от тела с более высокой температурой к телу с более низкой температурой до теп пор пока тела не придут в состояние теплового равновесия (сравняются их температуры). При этом совершается механическая работа, но между сталкивающимися молекулами, т. е. без макроскопического движения.
Количество теплоты (теплота) (Q) – энергия, переданная телу в результате теплообмена.
Количество теплоты, необходимое для нагревания тела
Q = cmDT.
Удельная теплоемкость вещества (с). Численно равна количеству теплоты, необходимому для нагрева 1 кг вещества на 1 К. В системе СИ единица удельной теплоемкости – 1 Дж/(кг×К). Эта величина не является однозначной характеристикой вещества, а зависит от условий при которых происходило нагревание.
Количество теплоты, необходимое для превращения жидкости в пар при постоянной температуре
Q = rm.
Удельная теплота парообразования (r). Численно равна количеству теплоты, необходимому для превращения в пар 1 кг жидкости. В системе СИ единица удельной теплоты парообразования – 1 Дж/кг.
Количество теплоты, необходимое для плавления кристаллического вещества
Q = lm.
Удельная теплота плавления (l). Численно равна количеству теплоты, необходимому для плавления 1 кг кристаллического вещества. В системе СИ единица удельной теплоты плавления – 1 Дж/кг.
Количество теплоты, выделяющееся (передаваемое другим телам) при сгорании вещества
Q = qm.
Удельная теплота сгорания (q). Численно равна количеству теплоты, выделяющемуся при сгорании 1 кг вещества. В системе СИ единица удельной теплоты сгорания – 1 Дж/кг.
Теплоизолированная система – система тел, которые не совершают теплообмен с телами, не входящими в систему.
Уравнение теплового баланса для теплоизолированной системы и при отсутствии работы внешних сил
Q1 + Q2 + Q3 + ... = 0.
Здесь Q1, Q2, Q3 – количества теплоты, которые получают (отдают) отдельные тела системы. Если тело получает энергию, то теплота берется положительной, и отрицательной в противном случае.
Работа при расширении газа (A)
A = pDV.
При сжатии газа А < 0. Эта формула справедлива для изобарного процесса или при незначительном изменении объема, когда изменением давления можно пренебречь.
Работа идеального газа при изобарном процессе (при изменении температуры газа на DU)
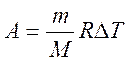 .
.
Работа внешних сил (действующих на газ) (A')
А' = – A.
Закон сохранения энергии в тепловых процессах (первый закон термодинамики). Изменение внутренней энергии системы равно сумме количества теплоты, переданного системе, и работы внешних сил
DU = Q + А'.
Количество теплоты, переданной системе, равно сумме изменения ее внутренней энергии и работы, совершаемой системой
Q = DU + А.
Для замкнутого процесса (система возвращается в исходное состояние, т. е. все параметры системы принимают первоначальные значения) DU = 0, поэтому Q= А. То же самое справедливо для изотермического процесса идеального газа при постоянных массе и молярной массе. Для изохорного процесса А = 0, поэтому DU = Q. Для изобарного процесса
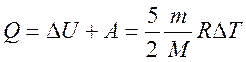 .
.
Адиабатный процесс – процесс происходящий в системе при отсутствии теплообмена с окружающими телами, т. е. при Q = 0. Отсутствие теплообмена может быть обеспечено хорошей теплоизоляцией. Кроме того, быстрые процессы, происходящие за время, которое много меньше времени, за которое устанавливается тепловое равновесие, также приближенно можно считать адиабатными. В соответствии с первым законом термодинамики для адиабатного процесса
DU = А'.
|
Рисунок 6 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.