



























































1. Виды движения в молекуле. Типы молекулярных спектров.
Существуют следующие виды движения молекулы:
Электронное движение молекулы – это движение электронов молекулы относительно ее ядер.
Колебательное движение молекулы – это периодическое изменение взаимного расположения ядер (межъядерных расстояний и валентных углов).
Вращательное движение молекулы – это периодическое изменение ориентации молекулы как целого в пространстве.
Функция состояния движения молекулы ![]() является функцией 3nкоординат
электронов (без учета спина) и 3N координат ядер.
является функцией 3nкоординат
электронов (без учета спина) и 3N координат ядер.
В квантовой механике, как и в классической, можно
движение молекулы рассматривается в системе координат, начало которой совмещено
с центром инерции. Число степеней свободы (или независимых координат) в этом
случае: для электронного движения – ![]() ; для движения ядер –
; для движения ядер – ![]() . Ядра молекулы участвуют в колебательном
и вращательном движении. Для нелинейной молекулы число вращательных
степеней свободы
. Ядра молекулы участвуют в колебательном
и вращательном движении. Для нелинейной молекулы число вращательных
степеней свободы ![]() равно 3; для линейной –
равно 3; для линейной – ![]() =2. Остальные
=2. Остальные ![]() (для
нелинейной молекулы) или
(для
нелинейной молекулы) или ![]() (для линейной
молекулы) являются колебательными (таблица 1.2).
(для линейной
молекулы) являются колебательными (таблица 1.2).
Таблица 1.2 Число степеней свободы молекулы в системе центра масс
|
|
|
|
|
|
Линейная молекула |
2 |
3N-5 |
3n |
|
Нелинейная молекула |
3 |
3N-6 |
3n |
Общее решение квантовомеханической задачи для молекулы в системе центра масс в адиабатическом приближении имеет следующую структуру:
y (x, q, q) =ye (x, q) yυ (q) yJ (q);
E = Ее+ Eυ + EJ .
Энергия молекулы каждого вида (электронная Ее ,колебательная Еυ , вращательная EJ) – величина в общем случае квантованная, т.е. каждому виду движения соответствует своя совокупность энергетических уровней. Разрешенные переходы между энергетическими уровнями Ее , Еυ , EJ обусловливают полный спектр молекулы.
Между значениями энергий Ее , ![]() и EJ
имеет место соотношение:
и EJ
имеет место соотношение:
Ее (~1 эВ)>>Eυ ( ~10-1![]() 10-2
эВ) >>EJ(~10-3
10-2
эВ) >>EJ(~10-3![]() 10-4 эВ).
10-4 эВ).
Изменения энергии различных видов при квантовых переходах соотносятся таким же образом : DEe>>DEυ>>DEJ. Именно поэтому различные типы переходов (электронные, колебательные, вращательные) проявляются в различных областях спектра. Квантовые переходы между электронными уровнями обусловливают электронные спектры молекулы, которые проявляются в видимой и УФ областях (при переходах валентных электронов), а также - в рентгеновской области (при переходах электронов внутренних электронных оболочек). Колебательные переходы обусловливают колебательные спектры молекулы, которые проявляются в ближней и средней ИК области (поглощение и испускание), а также в спектрах комбинационного рассеяния (КР), располагающихся как правило в видимой области. Вращательные переходы обусловливают вращательные спектры молекулы, которые проявляются в дальней ИК и микроволновой (МВ) области (поглощение и испускание), а также в спектрах КР.
Рассмотрим принципиальную схему энергетических уровней двухатомной молекулы, изображенную на рисунке
Энергия молекулы в целом (с учетом всех видов движения) может быть представлена следующим образом:
Е= Ее+Еυ+ЕJ+Ueυ+UeJ+UυJ , (1.7)
где Ueυ ,UeJ ,UυJ – энергия молекулы, обусловленная взаимным влиянием её различных форм движения друг на друга.
Поскольку Ueυ ,UeJ ,UυJ малы по сравнению с Ее, Еυ, ЕJ, ими на первом этапе рассмотрения можно пренебречь (адиабатическое приближение). Тогда полная энергия молекулы в системе её центра масс может быть представлена следующим образом:
![]() . (1.8)
. (1.8)
При заданных условиях молекула имеет вполне
определенную энергию Е=Ее=Еv+EJ ,
т.е. находится в определенном электронно-колебательно-вращательном стационарном
состоянии. При переходе из одного квантового состояния в другое в общем случае
меняются значения всех трех видов энергии. Например, в результате перехода
молекулы из состояния с энергией ![]() в состояние с энергией
в состояние с энергией ![]() испускается квант излучения
испускается квант излучения
![]() .
.
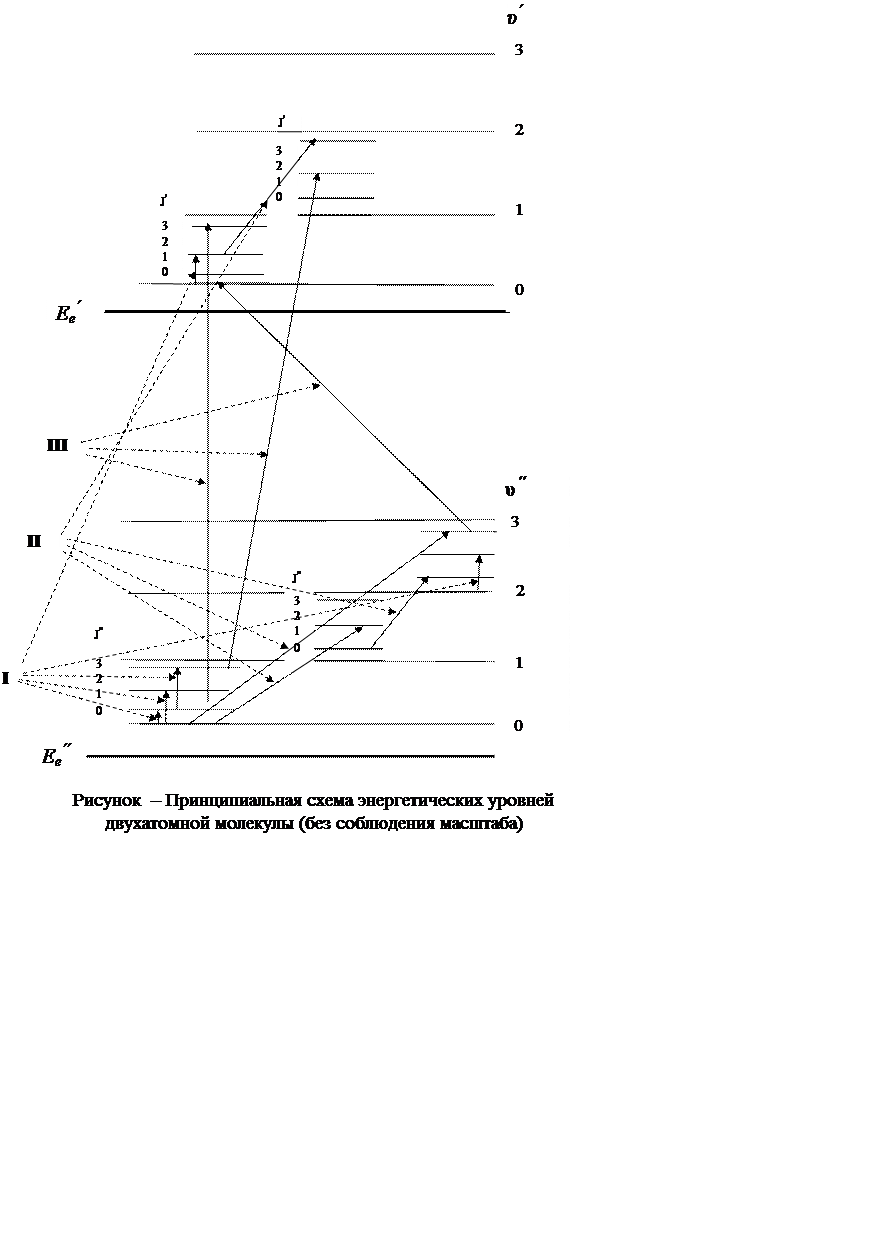
Изменение энергии молекулы, равной по порядку величины
с изменением её электронной энергии, сопровождается изменением её колебательной
![]() и вращательной
и вращательной ![]() энергии.
Возникающие при этом спектры являются электронно-колебательно-вращательными
(переходы III на рисунке 1.3) и имеют полосатую структуру. Кратко
их называют электронными. Если в результате квантового перехода электронное
состояние не меняется, а происходит одновременное изменение колебательной и
вращательной энергии молекулы, возникают спектры, называемые
колебательно-вращательными, или просто колебательными (переходы II).
Эти спектры также имеют полосатую структуру. Если в результате квантового
перехода изменяется только вращательная энергия молекулы, возникает
вращательный спектр (переходы I), имеющий линейчатую структуру.
энергии.
Возникающие при этом спектры являются электронно-колебательно-вращательными
(переходы III на рисунке 1.3) и имеют полосатую структуру. Кратко
их называют электронными. Если в результате квантового перехода электронное
состояние не меняется, а происходит одновременное изменение колебательной и
вращательной энергии молекулы, возникают спектры, называемые
колебательно-вращательными, или просто колебательными (переходы II).
Эти спектры также имеют полосатую структуру. Если в результате квантового
перехода изменяется только вращательная энергия молекулы, возникает
вращательный спектр (переходы I), имеющий линейчатую структуру.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.