Лабораторная работа 6
Законы электролиза
Цель работы: изучить законы электролиза, определить электрохимический эквивалент вещества и заряд иона меди.
Задание 1. Определить электрохимический эквивалент вещества. Вычислить заряд иона.
Приборы и принадлежности: источник постоянного тока, электролитическая ванночка с угольным и медным электродами, амперметр, реостат и ключ.
Теория метода
Многие жидкости очень плохо проводят электрический ток, например, дистиллированная вода, керосин, глицерин и т. д. Наоборот, водные растворы солей, кислот и щелочей хорошо проводят электрический ток. Прохождение тока через эти жидкости вызывает выделение их составных частей на электродах. Это явление получило название электролиза, а сами жидкости были названы электролитами.
Прохождение тока через электролиты неразрывно связано с переносом вещества. Отсюда следует, что в электролитах в отличие от металлических проводников, носителями тока являются не свободные электроны, а ионы – заряженные частицы вещества. Ионы представляют собой атомы или группы атомов, обладающие избыточным или недостаточным количеством электронов по сравнению с нейтральными атомами или молекулами. Процесс расщепления нейтральных молекул жидкости на заряженные ионы называется электролитической диссоциацией.
В данной работе в емкость С налит водный раствор медного купороса CuSО4. В нее опущены два электрода: В – угольный и D – медный (рис. 1).
|
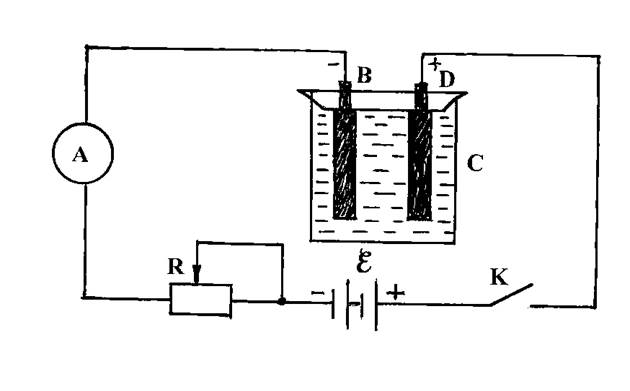
К электродам присоединены через реостат амперметр А и ключ К, а также источник постоянного тока. Угольный электрод В соединен с отрицательным полюсом батареи. Между электродами в растворе образуется электрическое поле. Под влиянием этого поля ионы, на которые диссоциировали в растворе молекулы медного купороса, начнут двигаться. В результате через раствор пойдет ток.
Пропуская ток через раствор медного купороса, легко заметить, как на темной поверхности угольного катода осаждается красноватый слой меди. Это убеждает нас, что медь присутствовала в растворе в виде положительных ионов. Остальная часть диссоциированной молекулы CuSO4, т. е. группа SO4 должна образовать отрицательные ионы. Таким образом, молекулы медного купороса диссоциируют при растворении в воде на положительные ионы меди Cu и отрицательные ионы SO4, что запишется следующим образом
![]()
Двойные
значки «+ +» и «– –» означают, что ионы являются двухзарядными, т. е. возникают
соответственно в результате потери двух электронов и захвата двух лишних
электронов. В нашем примере отрицательно заряженные ионы ![]() , нейтрализовавшись у медного анода,
вступают с ним в химическую реакцию и образуют вновь молекулы медного купороса
, нейтрализовавшись у медного анода,
вступают с ним в химическую реакцию и образуют вновь молекулы медного купороса
![]() .
.
В результате количество медного купороса в растворе остается неизменным, на катоде же выделяется медь.
Законы электролиза были экспериментально установлены Фарадеем в 1834 году.
Первый закон Фарадея: масса m выделившегося на электроде вещества прямо пропорциональна электрическому заряду q, прошедшему через электролит
![]() (1)
(1)
Коэффициент пропорциональности k, численно равный массе вещества, выделившегося при прохождении через электролит единицы электрического заряда, называется электрохимическими эквивалентом вещества.
Если через электролит пропускается постоянный ток I в течение времени t, то
![]() ,
,
и уравнение (1) можно записать в виде
![]() .
(2)
.
(2)
Второй закон Фарадея: электрохимический эквивалент вещества прямо пропорционален его химическому эквиваленту
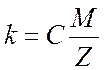 ,
(3)
,
(3)
где отношение молярной массы М вещества к его
валентности Z, т. е. ![]() называют химическим эквивалентом,
называют химическим эквивалентом, 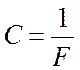 – универсальная постоянная для всех
элементов. Величину F называют числом или постоянной Фарадея
– универсальная постоянная для всех
элементов. Величину F называют числом или постоянной Фарадея 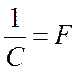 .
.
Объединяя оба закона, можно записать
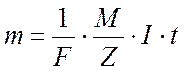 (4)
(4)
Из
формулы (4) следует, что если 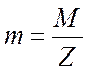 , т. е. если при электролизе выделяется один килограмм–эквивалент
вещества, то q численно равно F. Следовательно, число Фарадея равно электрическому
заряду, который необходимо пропустить через электролит для выделения на
электроде одного
, т. е. если при электролизе выделяется один килограмм–эквивалент
вещества, то q численно равно F. Следовательно, число Фарадея равно электрическому
заряду, который необходимо пропустить через электролит для выделения на
электроде одного
килограмм-эквивалента вещества.
Как показали опыты,
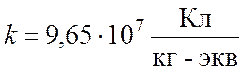 .
.
Количество
атомов ![]() в килограмм-эквиваленте вещества зависит
от валентности элемента n и, очевидно, равно
в килограмм-эквиваленте вещества зависит
от валентности элемента n и, очевидно, равно
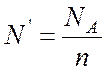 , где NА – число Авогадро.
, где NА – число Авогадро.
Отсюда заряд одного иона равен
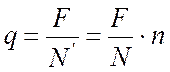 .
.
Наименьший
заряд иона е соответствует заряду одновалентного
иона
(n =
1), откуда
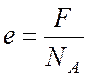 .
(5)
.
(5)
Так как валентность элемента выражается целым числом n, то заряд q, переносимый любым ионом равен
![]() (6)
(6)
Таким образом, законы Фарадея в совокупности с атомной теорией вещества приводят к представлению об атомном строении электричества. Каждый атом вещества может терять или присоединять к себе заряд кратный элементарному заряду е. Очевидно, этот элементарный заряд представляет собой заряд электрона. Выражение (6) – условие квантования заряда.
Выполнение работы
Задание 1. Определить электрохимический эквивалент вещества. Вычислить заряд иона меди
1. Измерьте массу m1 сухого угольного электрода на весах с точностью не менее 10 мг.
2. Закрепите угольный электрод на крышке стакана с помощью стопорного винта.
3. Опустите электроды в емкость с водным раствором медного купороса. Ключ К – разомкнут.
4. Соберите цепь согласно схеме (рис. 1). Включите источник питания в сеть и установите напряжение на выходе источника ~ 6 В. Замкните ключ К. Установите реостатом R ток I = 0,5 А. Пропускайте ток через электролит в течении 15 мин.
5. Отключите установку: отключите источник питания и разомкните ключ К.
6. Выньте электроды из емкости.
7. Снимите угольный электрод с крышки, и высушите над плиткой (предварительно прополоскав его в сосуде с водой или под краном с холодной водой).
8. Измерьте массу m2 угольного электрода вторично.
9. Найдите массу выделившейся меди m
m = m2 – m1
10. По формуле (2) вычислите k.
11. Вычислить число Фарадея F и заряд иона меди.
10. Полученные данные занести в табл. 1.
Таблица 1
|
Номер опыта |
Наименование показателей |
|||||||
|
I, А |
t, с |
m1, г |
m2, г |
m, кг |
K, |
F, |
e, Кл |
|
|
1 |
||||||||
Контрольные вопросы
1. Объясните явление электролиза.
2. Сформулируйте и объясните законы Фарадея.
3. Будут ли заряды тела кратными е? Пояснить.
4. Почему дистиллированная вода является хорошим растворителем?
5. Раскройте физический смысл электрохимического эквивалента и числа Фарадея.
6. Что такое килограмм-эквивалент вещества?
7. Что такое степень или коэффициент диссоциации?
8. Характер диссоциации кислот, оснований и щелочей.
Библиографический список
1. Грабовский Р. И. Курс физики / Р. И. Грабовский. – М.: Высш. шк., 1984. – Гл. XIII. – С. 301–306 (Постоянный электрический ток. § 91. Ток в жидкостях. Электролиз. Законы Фарадея).
2. Калашников С. Г. Электричество / С. Г. Калашников. – М.: Наука, 1985. – Гл. XXIII. – С. 400–403 (Электрический ток в электролитах. § 189. Законы электролиза Фарадея. §190. Электролитическая диссоциация).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.