-67–
ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО
После того как были получены точные выражения для решения уравнения Шредингера для атома водорода и выяснено, что главное квантовое число однозначно определяет энергию электрона в атоме, интересно было бы выяснить значения орбитального и магнитного квантовых чисел, а также то с какими величинами они связаны в атоме. Рассмотрим дифференциальное уравнение для радиальной части волновой функции:
 (e1)
(e1)
Это уравнение связано только с радиальным движения электрона, т.е. с движением к ядру и от него, однако в него входит и полная энергия электрона, которую можно разбить на три части: электростатическую, кинетическую радиальную и кинетическую орбитальную –
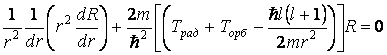 (e2)
(e2)
![]() связана только с радиальными перемещениями электрона (например, при
переходе с одной орбиты на другую), а
связана только с радиальными перемещениями электрона (например, при
переходе с одной орбиты на другую), а ![]() даёт кинетическую энергию при движении по орбите
постоянного радиуса, хотя и является функцией радиуса, но не связана с движением
вдоль радиуса и её присутствие в данном уравнении кажется по крайней мере
странным. Вот если бы два последних члена в квадратных скобках взаимно
уничтожались, то тогда никаких проблем бы не возникало – в уравнении оставались
бы только функции радиуса. Положим, что так он и есть, то есть
даёт кинетическую энергию при движении по орбите
постоянного радиуса, хотя и является функцией радиуса, но не связана с движением
вдоль радиуса и её присутствие в данном уравнении кажется по крайней мере
странным. Вот если бы два последних члена в квадратных скобках взаимно
уничтожались, то тогда никаких проблем бы не возникало – в уравнении оставались
бы только функции радиуса. Положим, что так он и есть, то есть
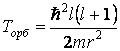 (e3)
(e3)
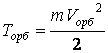 ;
; ![]() ;
; ![]()
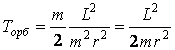 сравнивая с (е3)
сравнивая с (е3)
получаем
![]() (е4)
(е4)
![]() (е5)
(е5)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.