

Санкт – Петербургский государственный горный институт им. Г. В. Плеханова
(технический университет)
“Фотометрия”
Выполнил: студент гр. ЭП – 00 Маркелов А. А.
Проверил: доцент __________ Зайцев Ю. А.
Санкт – Петербург
2003
Фотометрия – это такой метод анализа веществ, при котором количество определяемого вещества определяется по интенсивности его окраски.
Основными величинами, используемыми в фотометрии
являются: 1) Т – доля падающего светового потока, проходящего через
раствор, другими словами пропускание в зависимости от длины волны ![]() , [Т]=%; 2) D (встречается
также обозначение А) – оптическая плотность, D=-lgT.
, [Т]=%; 2) D (встречается
также обозначение А) – оптическая плотность, D=-lgT.
Интенсивность светового потока на входе в раствор отличается от интенсивности на выходе из него, таким образом, для определения величины пропускания Т и оптической плотности D можно использовать следующие формулы:
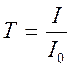
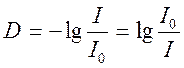
Основным законом фотометрии является закон Ламберта – Бугера – Бера:
![]() ,
,
где с – концентрация окрашенного вещества в растворе, [моль/л];
l – толщина поглощающего слоя, [см];
![]() - молярный коэффициент
поглощения (это постоянная величина для данного вещества и данной длины волны).
- молярный коэффициент
поглощения (это постоянная величина для данного вещества и данной длины волны).
Для проведения фотометрических анализов используют специальные приборы – фотокалориметры. Существует несколько моделей фотокалориметров, но принцип действия у них практически одинаковый, к тому же они состоят из одних и тех же элементов: источника света, конденсора, светофильтра, диафрагмы, фотоэлемента и микроамперметра.
Задание на первую часть лабораторной работы:
1. Приготовить 0,01 N растворы KMnO4, CuSO4, K2Cr2O7 (из фиксаналов).
2.
Снять спектры поглощения этих
растворов при ![]() нм.
нм.
3. Выбрать максимальные значения длин волн.
4. Построить калибровочные графики для максимальных значений длин волн для определения концентраций указанных растворов по оптической плотности.
Тип прибора: КФК – 2МП, микропроцессор; толщина поглощающего слоя: 1,0037 см для раствора и 1,0040 см для воды.
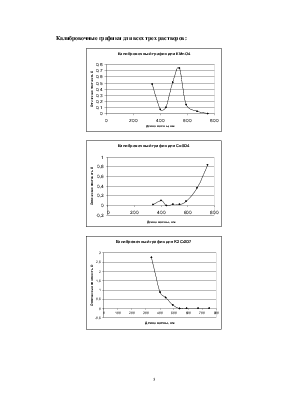
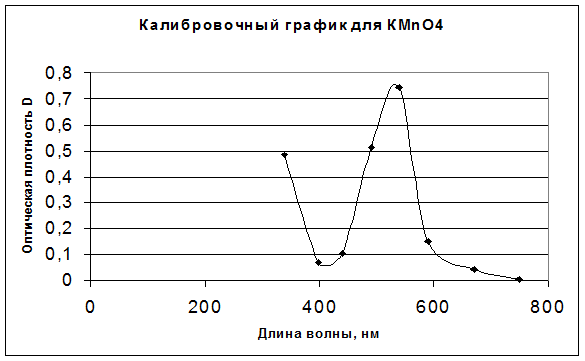
Результаты анализа KMnO4:
|
|
340 |
400 |
440 |
490 |
540 |
590 |
670 |
750 |
|
Т, % |
32,89 |
85,17 |
78,86 |
30,56 |
78,00 |
70,81 |
90,73 |
99,40 |
|
D |
0,484 |
0,070 |
0,103 |
0,515 |
0,745 |
0,150 |
0,042 |
0,003 |
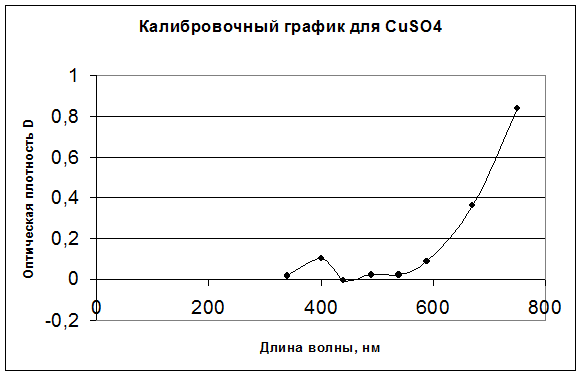
Результаты анализа CuSO4:
|
|
340 |
400 |
440 |
490 |
540 |
590 |
670 |
750 |
|
Т, % |
95,71 |
78,83 |
100,00 |
99,55 |
95,55 |
82,15 |
43,61 |
14,42 |
|
D |
0,019 |
0,103 |
0,000 |
0,020 |
0,020 |
0,086 |
0,361 |
0,841 |
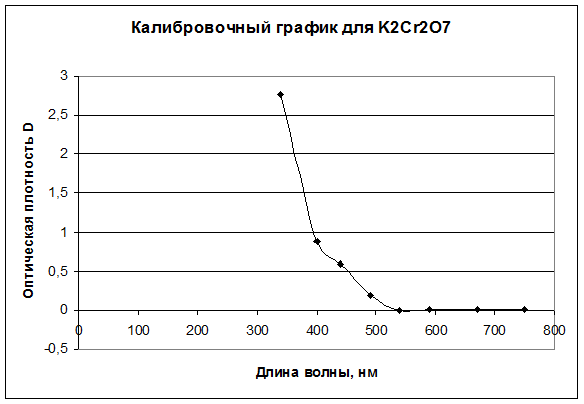
Результаты анализа K2Cr2O7:
|
|
340 |
400 |
440 |
490 |
540 |
590 |
670 |
750 |
|
Т, % |
0,176 |
13,12 |
25,13 |
65,19 |
99,42 |
96,91 |
97,60 |
97,74 |
|
D |
2,764 |
0,883 |
0,597 |
0,186 |
0,003 |
0,014 |
0,011 |
0,010 |
Калибровочные графики для всех трех растворов:
Задание на вторую часть лабораторной работы:
1.
Приготовить шесть растворов KMnO4
с различной концентрацией марганца в них (СMn=2, 4, 8, 12, 16, 20
мг/л). Для этого предварительно 0,1 N раствор KMnO4 (исходная
концентрация раствора ![]() =3,16 мг/мл) разбавляется в 20
раз. Далее производится поэтапное приготовление растворов с нужными
концентрациями марганца в мерных колбах по 50 мл.
=3,16 мг/мл) разбавляется в 20
раз. Далее производится поэтапное приготовление растворов с нужными
концентрациями марганца в мерных колбах по 50 мл.
2.
Каждый полученный раствор
проанализировать на фотокалориметре КФК – 2МП, причем необходимо измерять
оптическую плотность растворов при одной и той же длине волны. Так как в первой
части лабораторной работы при анализе раствора KMnO4 оптическая
плотность была максимальна при длине волны ![]() =540 нм
(зеленый цвет), то в этой части лабораторной работы анализ всех шести растворов
должен проводится при указанной выше длине волны.
=540 нм
(зеленый цвет), то в этой части лабораторной работы анализ всех шести растворов
должен проводится при указанной выше длине волны.
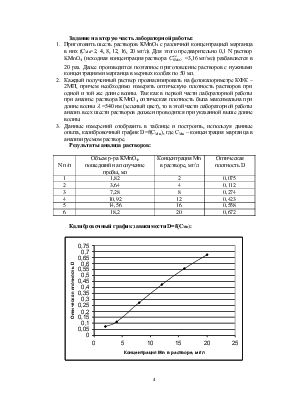
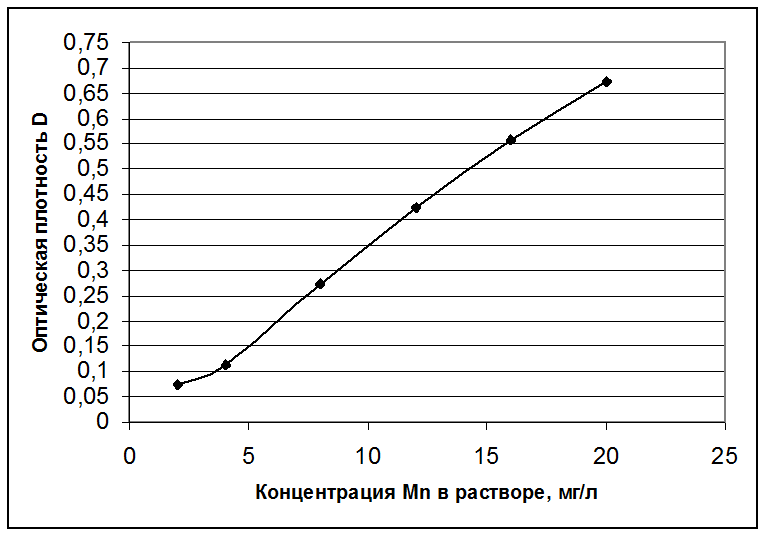
3. Данные измерений отобразить в таблице и построить, используя данные опыта, калибровочный график D=f(CMn), где СMn – концентрация марганца в анализируемом растворе.
Результаты анализа растворов:
|
N п/п |
Объем р-ра KMnO4, пошедший на получение пробы, мл |
Концентрация Mn в растворе, мг/л |
Оптическая плотность D |
|
1 |
1,82 |
2 |
0,075 |
|
2 |
3,64 |
4 |
0,112 |
|
3 |
7,28 |
8 |
0,274 |
|
4 |
10,92 |
12 |
0,423 |
|
5 |
14,56 |
16 |
0,558 |
|
6 |
18,2 |
20 |
0,672 |
Калибровочный график зависимости D=f(CMn):
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.