



Федеральное агентство по образованию
Санкт-Петербургский государственный горный институт им. Г.В. Плеханова
(технический университет)

Отчет
по лабораторной работе №4:
«Фотометрическое определение никеля с диметилглиоксимом»
Выполнил: студент группы ЭП - 03 Леонов А.В.
Проверил: профессор каф. ОиФХ Чиркст Д. Э.
Санкт-Петербург
2005 год
Фотометрическое определение никеля
с диметилглиоксимом.
Цель работы. Фотометрическое определение концентрации никеля в растворе по измеренному значению оптической плотности при помощи калибровочного графика, построенного по серии стандартных растворов.
Сущность работы. Определение концентрации никеля основано на реакции образования в щелочной среде внутрикомплексного соединения никеля с диметилглиоксимом (реактивом Чугаева).
Продукт окисления диметилглиоксима, образующий с никелем ярко окрашенное соединение, неустойчив, поэтому окислитель, а затем щелочь необходимо прибавлять последними к заранее приготовленной смеси растворов никеля с диметилглиоксимом. Раствор окрашенного комплекса имеет максимум поглощения при длине волны 470 нм. Небольшие количества (0,25 – 0,5 мг) Co, Cr, Mn не мешают определению никеля. Для предотвращения осаждения малых количеств железа (III) и алюминия добавляют сегнетову соль (тартрат калия-натрия), образующую прочные комплексы с указанными элементами. Чувствительность реакции - 2 мкг в 50 мл конечного объема при толщине слоя 5 см.
Приборы и реактивы
Фотоколориметр КФК-3
Мерные колбы на 50 мл – 7 шт.
Мерные колбы на 100 мл – 2 шт.
Пипетки градуированные на 1 и 10 мл
Стандартный раствор соли никеля концентрацией 1 г/л
Рабочий раствор соли никеля – концентрацией 25 мг/л (готовится разбавлением стандартного раствора в мерной колбе на 100 мл)
Тартрат калия-натрия (сегнетова соль) – 20% раствор
Гидроксид натрия – 5% раствор
Персульфат аммония – 5% раствор
Диметилглиоксим – 1% спиртовый раствор или 1% раствор в 5% растворе NaOH
Задачи с исследуемым раствором, приготовленные разбавлением стандартного раствора в 1,5 – 4 раза.
Выполнение работы
Построение калибровочного графика.
Для построения графика в мерные колбы на 50 мл последовательно вливают 2; 4; 6; 8; 10 мл рабочего раствора соли никеля, 5 мл сегнетовой соли, 5 мл гидроксида натрия, 5 мл персульфата аммония и 5 мл диметилглиоксима. Спустя 2 – 3 минуты объем каждой колбы доводят дистиллированной водой до метки и тщательно перемешивают. Через 5 – 7 минут измеряют оптическую плотность раствора при длине волны 470 нм. Раствор сравнения – все реагенты в отсутствие никеля.
Определение никеля в исследуемом растворе. В мерную колбу помещают 5 – 10 мл исследуемого раствора, содержащего 1 – 5 мг никеля, и далее поступают так же, как и при построении калибровочного графика. По калибровочной зависимости определяют концентрацию исследуемого раствора.
|
№ |
V Ni |
C Ni |
D |
|
2 |
2 |
1 |
0,288 |
|
3 |
4 |
2 |
0,663 |
|
4 |
6 |
3 |
1,022 |
|
5 |
8 |
4 |
1,102 |
|
6 |
10 |
5 |
1,228 |
![]()
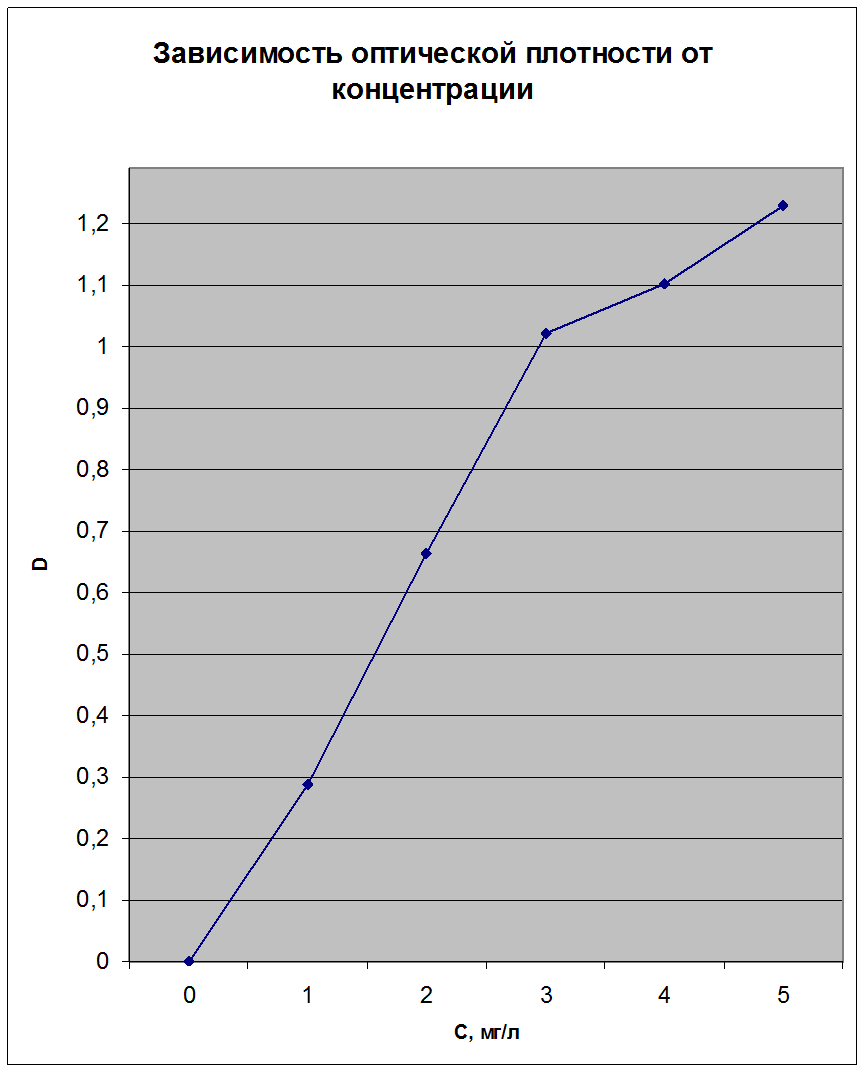
Вывод: Я определил оптическую плотность ![]() в задаче фотометрическим способом с
помощью калибровочного графика,
в задаче фотометрическим способом с
помощью калибровочного графика, ![]() ,
а по оптической плотности определил концентрацию
,
а по оптической плотности определил концентрацию ![]() .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.