
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Российской Федерации
Санкт-Петербургский государственный горный институт им. Г.В. Плеханова
(технический университет)

(наименование учебной дисциплины согласно учебному плану)
Выполнил: студент гр. АПМ-03 ______________ /Никифоров М.Н./
(подпись) (Ф.И.О.)
(подпись) (Ф.И.О.)
Санкт-Петербург
2006 год.
Цель работы: ознакомиться с принципом действия промышленного pH-метра. Провести поверку преобразователя и измерительного комплекта.
Общие сведения.
Потенциометрические анализаторы.
Принцип действия потенциометрических анализаторов относится к электрохимическим средствам измерений, которые основаны на измерении потенциала электрода, размещенного в электролите. По этому потенциалу определяется концентрация компонента анализируемого вещества. Эти анализаторы используются как для измерения концентраций различных ионов в жидкостях (ионометрия), так и для контроля окислительно-восстановительного (редокс) потенциала (редоксиметрия).
Потенциал, например, металла в растворе его собственных ионов равен:
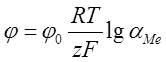 ,
,
где ![]() -
стандартный электродный потенциал (потенциал металла в растворе с активностью
ионов металла, равной 1 при
-
стандартный электродный потенциал (потенциал металла в растворе с активностью
ионов металла, равной 1 при ![]() );
); ![]() универсальная газовая постоянная;
универсальная газовая постоянная; ![]() абсолютная температура;
абсолютная температура; ![]() число Фарадея;
число Фарадея; ![]() -валентность
ионов металла в растворе;
-валентность
ионов металла в растворе; ![]() активность ионов металла
в растворе.
активность ионов металла
в растворе.
При ![]() выражение принимает вид:
выражение принимает вид:
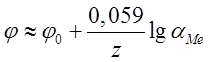 .
.
Таким образом, зная ![]() и измерив
и измерив ![]() , можно
найти активность ионов металла в растворе, а затем концентрацию ионов, если
известен коэффициент активности.
, можно
найти активность ионов металла в растворе, а затем концентрацию ионов, если
известен коэффициент активности.
В силу того, что электродный потенциал непосредственно измерить нельзя, его измеряют косвенным путем по ЭДС гальванического элемента, составляемого из измерительного (индикаторного) электрода 1 и сравнительного (вспомогательного) электрода 2. Оба электрода погружены в исследуемую жидкость, протекающую через ячейку 3 (рис.1).
|
Потенциал измерительного электрода меняется при изменении концентрации ионов в среде, а потенциал сравнительного – остается постоянным, т.к. он не зависит от концентрации ионов в среде. В промышленных системах автоматизации потенциометрические датчики представлены чаще всего измерительными ячейками со стеклянным электродом. С помощью этих датчиков измеряется активность водородных ионов в растворе (pH) и для измерения активности ионов натрия.
Действие
стеклянного электрода состоит в следующем. Если стекло в составе, которого
много силикатов щелочных металлов, обработать крепким раствором кислоты, то
поверхность стекла обменивает катионы щелочных металлов на ионы водорода и
становится “насыщенной” этими ионами. Помещенное в раствор с более низкой
активностью ионов ![]() стекло с такой поверхностью
отдает раствору часть своих катионов и заряжается отрицательно, выполняя, таким
образом, функции водородного электрода. Между поверхностью стекла и раствором
возникает разность потенциалов. Электродный потенциал стекла относительно
раствора зависит от активности
стекло с такой поверхностью
отдает раствору часть своих катионов и заряжается отрицательно, выполняя, таким
образом, функции водородного электрода. Между поверхностью стекла и раствором
возникает разность потенциалов. Электродный потенциал стекла относительно
раствора зависит от активности ![]() в растворе. Измерить
этот потенциал крайне сложно, так как стекло не является проводником. Эту
трудность обходят, выполнив стекло в виде тонкой пленки, разделяющей два
раствора с разной активностью водородных ионов. На каждой стороне этого стекла
возникают свои электродные потенциалы, разность которых определяется
соотношением этих активностей:
в растворе. Измерить
этот потенциал крайне сложно, так как стекло не является проводником. Эту
трудность обходят, выполнив стекло в виде тонкой пленки, разделяющей два
раствора с разной активностью водородных ионов. На каждой стороне этого стекла
возникают свои электродные потенциалы, разность которых определяется
соотношением этих активностей:
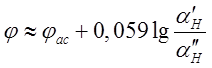 ,
,
где ![]() потенциал
асимметрии из-за неоднородности свойств двух поверхностей;
потенциал
асимметрии из-за неоднородности свойств двух поверхностей; ![]() поверхности.
поверхности.
Два раствора разделённых стеклянной пленкой,
представляют два гальванических полуэлемента, электрически связанных
перегородкой (мембраной) с большим сопротивлением. Для того, чтобы практически
измерить разность потенциалов этих полуэлементов, необходимо при каждом
полуэлементе иметь второй вспомогательный полуэлемент, выполняющий роль
электрода сравнения. В промышленных датчиках используют хлор- или
бром-серебрянные электроды. По конструкции это серебряная проволока, покрытая
губкой из ![]() (
(![]() ) и
погруженная в раствор.
) и
погруженная в раствор.
Конструктивно датчик рН-метра, как уже отмечалось, выполняется из двух электродов: измерительного и сравнительного. Первый состоит из трех полуэлементов: двух стеклянных и хлорсеребряного. Второй просто является хлорсеребряным полуэлементом.
В первом залит раствор ![]()
![]() . Во второй – раствор
. Во второй – раствор ![]()
![]() . Объем его делится на
два отсека резиновыми мембранами. Они предохраняют электрод от попадания внутрь
посторонних ионов. Электрический контакт между серебряным электродом и внешним
раствором осуществляется по поверхности прилегания мембран к стеклу (эти места
матированы).
. Объем его делится на
два отсека резиновыми мембранами. Они предохраняют электрод от попадания внутрь
посторонних ионов. Электрический контакт между серебряным электродом и внешним
раствором осуществляется по поверхности прилегания мембран к стеклу (эти места
матированы).
Датчики рН-метров выпускают в различном конструктивном оформлении: магистральные, погруженные и проточные. Первые устанавливаются в трубопроводах диаметром 25-150 мм. Погруженные устанавливаются в емкостях. Проточные предназначены для измерения рН пробы, отбираемой из основного потока технологической аппаратуры.
В общем, рН-метры со стеклянными измерительными
электродами позволяют измерять рН в интервале 0-14 с разными диапазонами. В
этом интервале ЭДС изменяется около 800 ![]() . Для
измерения этого потенциала используются устройства с высоким входным
сопротивлением
. Для
измерения этого потенциала используются устройства с высоким входным
сопротивлением ![]() МОм. Основной влияющей величиной
при потенциометрических измерениях является температура. Сигнал гальванической
ячейки потенциометрического анализатора с увеличением температуры по абсолютной
величине увеличивается в первом приближении по линейному закону.
МОм. Основной влияющей величиной
при потенциометрических измерениях является температура. Сигнал гальванической
ячейки потенциометрического анализатора с увеличением температуры по абсолютной
величине увеличивается в первом приближении по линейному закону.
Классы точности 0,5-10.
|
pH по шкале |
Табличное значение ЭДС, мВ |
Значение ЭДС по И-01, мВ |
Погрешность, мВ |
||||
|
Пр. ход |
Обр. ход |
Прямой ход |
Обратный ход |
||||
|
Абс. |
Прив. |
Абс. |
Прив. |
||||
|
5 |
-233,5 |
-247 |
-244 |
13,5 |
0,964 |
10,5 |
0,750 |
|
6 |
-311,6 |
-310 |
-310 |
1,6 |
0,114 |
1,6 |
0,114 |
|
7 |
-369,6 |
-370 |
-360 |
0,4 |
0,029 |
9,6 |
0,686 |
|
8 |
-427,7 |
-429 |
-420 |
1,3 |
0,093 |
7,7 |
0,550 |
|
9 |
-443 |
-489 |
-490 |
46 |
3,286 |
47 |
3,357 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.