




















Глава V. СИНТЕЗЫ НА ОСНОВЕ ОКСИДА УГЛЕРОДА
Органический синтез на основе оксида углерода получил за последние десятилетия очень большое промышленное развитие. Главное практическое применение получили следующие процессы:
1) синтезы из оксида углерода и водорода, применяемые для получения алифатических углеводородов и спиртов;
2) процессы оксосинтеза или гидроформилирования олефинов, ведущие к образованию альдегидов и из них первичных спиртов;
3) синтез карбоновых кислот и их производных (сложных эфиров, ангидридов и др.).
Масштабы производств на основе оксида углерода очень значительны. В США так получали около 4 млн. т метанола, свыше 1 млн. т альдегидов оксосинтеза, 0,45 млн. т н-бутанола, а также уксусную кислоту и ее ангидрид. В перспективе в связи с дефицитом нефти и газа роль этих процессов должна возрасти благодаря возможности их базирования на угле.
5.1. Синтезы на основе оксида углерода и водорода
Каталитические превращения СО и Н2 очень многообразны, но из них можно выделить два наиболее важных: синтез углеводородов, в том числе топлива, и получение спиртов, особенно метанола.
Синтез углеводородов из СО и Н2. Одной из хорошо известных реакций СО и Н2 является образование метана при катализе металлическим никелем при 200 – 250 °С под давлением:
СО + 3Н2
![]() СН4 + Н2О (5.1)
СН4 + Н2О (5.1)
Этот процесс метанирования сейчас усиленно разрабатывают с целью производства бытового газа из угля.
В 20-х годах Э. Фишер и Г. Тропш обнаружили, что из смеси СО и Н2 при добавлении к металлическим катализаторам щелочей и высоком давлении (10 – 15 МПа) образуется смесь кислородсодержащих соединений, а при понижении давления до 3 МПа получаются главным образом углеводороды. С кобальтом реакция шла с выделением воды, а с железом – с образованием диоксида углерода:
nСО + (2n+1)Н2
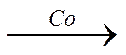 СnН2n+2 + nН2О (5.2)
СnН2n+2 + nН2О (5.2)
2nСО + (n+1)Н2
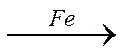 СnН2n+2 + nСО2 (5.3)
СnН2n+2 + nСО2 (5.3)
В то время СО и Н2 производили из угля, поэтому полученная смесь углеводородов была названа когазином (от Kohle – Gas – Benzin), а ее бензиновая фракция – синтином (синтетический бензин). В Германии до 1945 г. синтез моторного топлива по методу Фишера и Тропша получил значительное развитие, но сейчас во всем мире имеются лишь два завода в ЮАР, производящие углеводородное топливо из угля. Однако ведутся усиленные поиски более совершенной технологии, и в связи с нехваткой нефти вполне вероятно возрождение данного процесса.
Синтез углеводородов по методу Фишера и Тропша при умеренных условиях необратим и сопровождается очень большим выделением тепла (165 – 205 кДж на каждую группу СН2 в полученном углеводороде). Лучшим катализатором оказалось более теплопроводное и дешевое железо, промотированное 0,5% К2О и эффективно работающее при 220 – 320°С и 1,5 – 2,5 МПа. Имеются два варианта процесса – со стационарным и с псевдоожиженным катализатором, причем в обоих случаях организована эффективная система теплоотвода с охлаждением кипящим водным конденсатом и генерированием пара высокого давления.
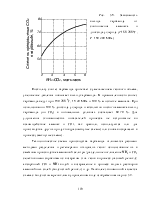
Получаемые продукты состоят из парафинов и олефинов, большей частью линейного строения и с концевым положением двойной связи, а также из некоторого количества кислородсодержащих соединений (спирты и кетоны). По фракционному составу углеводороды представляют собой смесь низших гомологов (С3 – С4), бензина, дизельного топлива, мягкого и твердого парафина. Групповой и фракционный состав продуктов можно заметно варьировать, изменяя температуру, давление и катализаторы. В частности, синтез можно направить на преимущественное образование углеводородов изостроения, обладающих более высоким октановым числом, линейных ос-олефинов и т.д.
Синтез углеводородов можно осуществить не только из СО и Н2, а и из метанола при катализе цеолитами. Имеются опытно-промышленные и одна промышленная установка получения из метанола высокооктанового бензина на сильнокислом цеолите ZSM-5. Реализованы два способа:
1) в две стадии в адиабатических реакторах со сплошным стационарным слоем катализаторов. На первой стадии осуществляется дегидратация метанола в диметиловый эфир и воду на А12О3 с образованием смеси продуктов, близкой к равновесной. Во втором реакторе при 340 – 410°С и 2 МПа на цеолите образуются бензин с выходом более 80 % и газообразные углеводороды. Последние рециркулируют в реактор второй ступени в 7–9-кратном избытке, что позволяет аккумулировать тепло реакции и проводить процесс в адиабатических условиях. Тепло горячих реакционных газов используют для получения пара;
2) в одну стадию в реакторе с псевдоожиженным слоем катализатора при 400°С и давлении 0,1 – 0,3 МПа. Тепло отводится в этом случае при помощи внутренних змеевиков, в которых циркулирует или водный конденсат или посторонний теплоноситель, генерирующий пар в выносном котле-утилизаторе.
Полученный бензин содержит значительное количество ароматических углеводородов, которые можно выделить из смеси рассмотренным ранее методом экстракции. В газе находятся низшие олефины и парафины. Выход олефинов повышается при катализе процесса слабокислыми алюмосиликатными или боро-силикатными цеолитами. В присутствии первых образуется больше этилена, они работают при температурах ниже 300°С или около 500°С; в присутствии вторых – больше пропилена и бутенов, они работают при 550°С.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.