Взаимодействие с HNO3.
|
Me+HNO3 |
NH3, NH4NO3 –активный металлы и очень разб. кислота. N2, N2O – металл средней активности и очень разб. кислота. NO –Металл средней и низкой активности и разбавленная кислота NO2 – любой металл и конц. кислота |
Взаимодействие с H2SO4 .
|
Me+H2SO4(конц.)= MeSO4+H2O+… |
H2S- активный металл (Mg,Al) S – Me средней активности (Zn,Fe) SO2 – Me средней и низкой активности |
![]()
Электрохимические процессы – это процессы при которых хим. энергия переходит в электрическую (гальвонические элементы) и наоборот. В основе всех Э.Х.П. лежит О.В.Р.
Электродный потенциал- это разность потенциалов возникающая на границе раздела двух фаз “металл-раствор”. Величина Эл. потенциала зависит от природы металла и растворителя, температуры и концентрации ионов металла в растворе. Эта зависимость выражается уравнением Нернста.
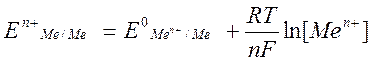 ж где R-const, n-число электронов, F-число фарадея, F=96500Кл/м
ж где R-const, n-число электронов, F-число фарадея, F=96500Кл/м ![]() - стандартный потенциал,
- стандартный потенциал, ![]() - потенциал электрода.
- потенциал электрода. 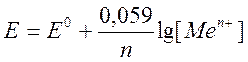
Гальвонический элемент- устройство в котором на основе окисл.-востановит. реакцииполучают эл. ток.
Он состоит из 2-х электродов- металлов, погруженных в растворы электролитов. Электрод, на котором в ходе реакции происходит процесс окисления (отдача электронов) называется анодом (А), а на котором осущ. восстановление( присоединение электронов) называется катодом (K). Анод- более активный металл, имеющий более отрицат. станд. эл. потенциал, он заряжен отрицательно. катод- менее активный металл.
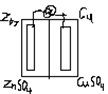 A(-) Zn/ZnSO4//CuSO4/Cu
K(+)
A(-) Zn/ZnSO4//CuSO4/Cu
K(+)
A(-) Zn0 -2e=Zn2+ окисление
K(+) Cu2+ +2e = Cu0 востановление
От Анода идёт эл. ток.!!!!!!!!!
Э.Д.С. гальвонического элемента= EK-EA. >0
Чем дальше стоят металлы друг от друга в ряду напряжений тем больше Э.Д.С. и эл. ток.
Концентрационные гальвонические элементы это элементы
составленные из одинаковых электродов опущенных в один и тот же раствор различающийся
концентрацией. Э.Д.С.КЭГ=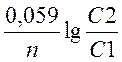 С2>С1
С2>С1
![]()
Электролиз- это процесс протекания химической реакции под действием эл.
тока. Эл. энергия превращается в химическую. Для этого нужен внешний источник
постоянного тока.
Электроды: 1) Нерастворимые (уголь, графит, платина иридий). 2)Растворимые (все остальные).
Последовательность разряда ионов. В водных растворах
электролитов кроме анионов и катионов имеются молекулы воды и продукты её
диссоциации. H2O![]() Поэтому у катода могут
разряжаться ионы H+ из молек. воды, а у
анода OH-.
Поэтому у катода могут
разряжаться ионы H+ из молек. воды, а у
анода OH-.
Из возм. процессов будет протекать ток который будет протекать с min затратой энергии.
Катодные процессы: опред. положение металлов в ряду напряжения.
1) Катионы активных металлов. Li+ до Al3+, Вместо них вост. H+ из H2O.
2) Металлы средней активности. Mn до H+. Востан. одновременно из молекул воды.
![]()
Zn (+)K, 2Cl (-)A
Zn2++2e=Zn0,
2HOH +2e=H2![]() +2OH
+2OH
3) Катионы малоактивных металлов (после H). Полностью вост. на катоде.
….
!!!Чем больше станд. потенциал металла, тем легче он будет восстанавливаться на катоде!!!
4) Кислые растворы. Вост. ионы водорода из кислоты.
….
Анодные процессы. Аноды: растворимые, нератворимые.
I. Нераств. аноды. (уголь, графит, платина, иридий) (S2-,B-,Cl-,F-)<=1,5В.
1) Окисл. в порядке увеличения станд. электродных потенциалов.
2) Анионы кислородных кислот. SO42-, PO43-, CO32-,No32-. Энергетически более выгодно окисление ионов OH из молекул водыс выделением O2.
…….
3) Щёлочи. Окисляются OH- и щелочей.
….
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.