Рассчитаем необходимое количество реагента.
1) Рассчитаем массу хлоридов цинка и меди.
m = c∙v, где m – масса вещества, с – концентрация ионов вещества в растворе, v – объём.
m (Zn) = 350* 30,4∙1000 = 10,64 кг.
Тогда масса хлорида цинка посчитаем по пропорции:
65 – 10,64
136 – х,
Отсюда х = 136*10,64/65 = 22,3 кг.
m (Сu) = 350* 30∙1000 = 10,5 кг.
Тогда масса хлорида меди посчитаем по пропорции:
63,5 – 10,5
133,5 – х1,
Отсюда х1 = 133,5*10,5/63,5 = 22 кг.
2) Рассчитаем массу полученного в результате реакции сульфида натрия. Для этого используем принцип эквивалентности.
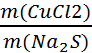 =
= 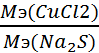 .
.
22 кг/x = (63,5+71)*2/((23*2+32)*2);
x
= 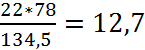 кг.
кг.
Значит, масса сульфида натрия равна 12,7кг. Рассчитаем необходимое количество реагента.
G (Na2S) = k*100/B* m(Na2S), где k = 1,1 ÷ 1,5 (в зависимости от реагентной чистоты), В – реагентная чистота вещества.
Тогда G (Na2S) = 1,3*100/67* 12,7 = 24,6 кг.
Следовательно, для проведения реагентной очистки необходимо 24,6 кг сульфида натрия.
Так как в соединении хлоридов цинка и меди на каждый атом цинка и меди требуется по два атома хлора, то необходимо рассчитать – достаточно ли ионов хлора содержится в данном растворе.
m (Cl) = 350*89/ 1000 = 31,15 кг.
Для образования 1 молекулы сульфида цинка или меди необходимо по 2 атома хлора, тогда
N (Zn) = 10,64/65 = 0,16 кмоль;
N (Сu) = 10,5/63 = 0,17 кмоль;
N (Cl2) = 31,15/35/2 = 0,445 кмоль.
Значит, на всю массу ионов меди и цинка необходимо 0,33 кмоль Сl2. Следовательно в растворе достаточно ионов хлора для образования необходимого количества хлоридов.
3) Рассчитаем концентрацию ионов натрия и хлора в полученном после очистки растворе.
31,15 – 35,5
х – 58,5, отсюда масса NaCl в полученном растворе равна 58,5*31,15/35,5 = 51,33 кг.
Рассчитаем массу натрия в данном веществе.
51,33 – 58,5
23 – х, отсюда масса натрия равна 26,2 кг.
Очень важно, чтобы вода, прошедшая очистку соответствовала нормам ПДК.
Определим количество ионов натрия в очищенной воде.
с = m/v = 26,2*1000/350 = 74,8 г/л.
Следовательно содержание ионов натрия в воде соответствует нормам ПДК.
Так как содержание ионов хлора в воде в процессе проведения очистки останется неизменно равным 89 мг/л, то концентрация ионов хлора в очищенной воде так же не превысит норм ПДК (см. табл. 1).
Значит, очищать полученную воду от ионов хлора и натрия нет необходимости.
Сульфиды меди и цинка можно отправить на обогатительный завод для получения чистых металлов, в данном случае меди и цинка.
Основным сырье для получения меди и цинка - сульфидные, реже – смешанные руды Большое значение приобретает переработка вторичного сырья, из которого в ряде развитых стран получают до 30-60% производимой меди. В связи с невысоким содержанием меди в рудах (0,5-1,2%) и их многокомпонентностью руды подвергают флотационному обогащению, получая попутно, помимо медного, и другие. концентраты, напр. цинковый, никелевый, молибденовый, пиритный, свинцовый. Содержание меди в медных концентратах достигает 18-45% [5].
В заключении работы можно сделать вывод о том, что выбранный реагентный метод подходит для очистки данных сточных вод гальванических цехов предприятия ОАО «Горьковский автомобильный завод». При этом полученная сточная вода будет полностью соответствовать нормам ПДК.
Также был подобран метод утилизации отходов – сульфидов меди и цинка полученных при реагентном методе очистки. Данный метод позволяет получать чистые металлы из уже отработанного сырья.
1. Константинов В.М. Охрана природы/ В.М.Константинов. – М.: Издательский центр «Академия», 2000.
2. Охрана окружающей среды: Учеб. для техн. спец. вузов / C. В. Белов, Ф. А. Барбинов, А. Ф. Козьяков и др. Под ред. С. В. Белова. 2-е изд., и доп. – М.: Высш. шк., 1991. – 319 с.: ил.
3. Ансеров Ю. М., Дурнев В. Л. Машиностроение и охрана окружающей среды. – Л.: Машиностроение. Ленингр. отд-ние, 1979. – 224 с., ил.
4. Защита водной среды от распространённых загрязнителей: учеб. пособие / В. К. Макаренко. – Новосибирск: НГТУ, 2005. – 52 с.
5. http://www.xumuk.ru
6. www.enh.by.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.