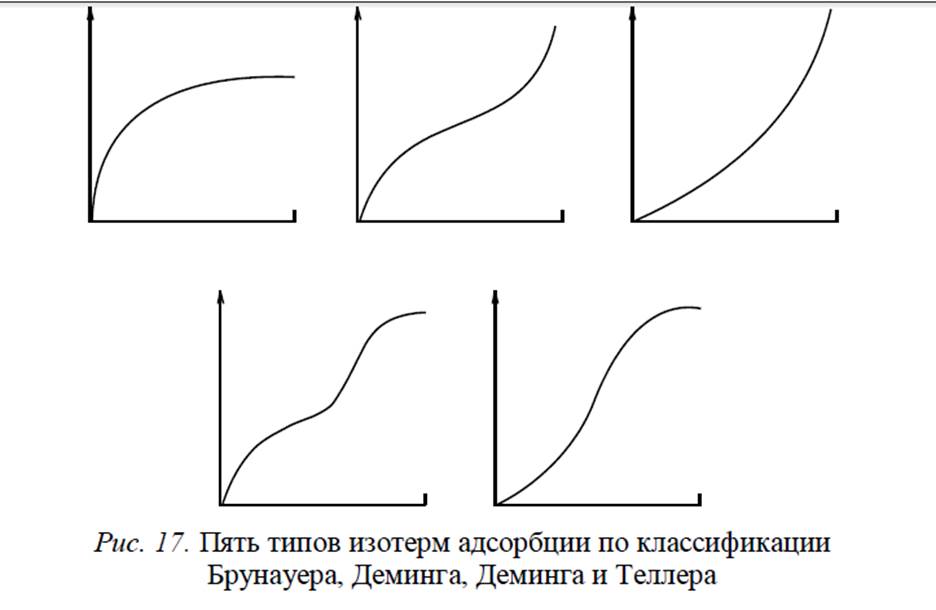
В литературе для большого ряда твердых тел приводятся десятки тысяч изотерм адсорбции. Однако все эти многочисленные изотермы, описывающие физическую адсорбцию, можно условно разбить на пять групп, соответствующих пяти группам классификации, первоначально предложенной Брунауером, Демингом, Демингом и Теллером (БДДТ). Сейчас чаще ссылаются на классификацию Брунауера, Эммета и Тел- лера (БЭТ). Эти типы изотерм показаны на рис. 17.
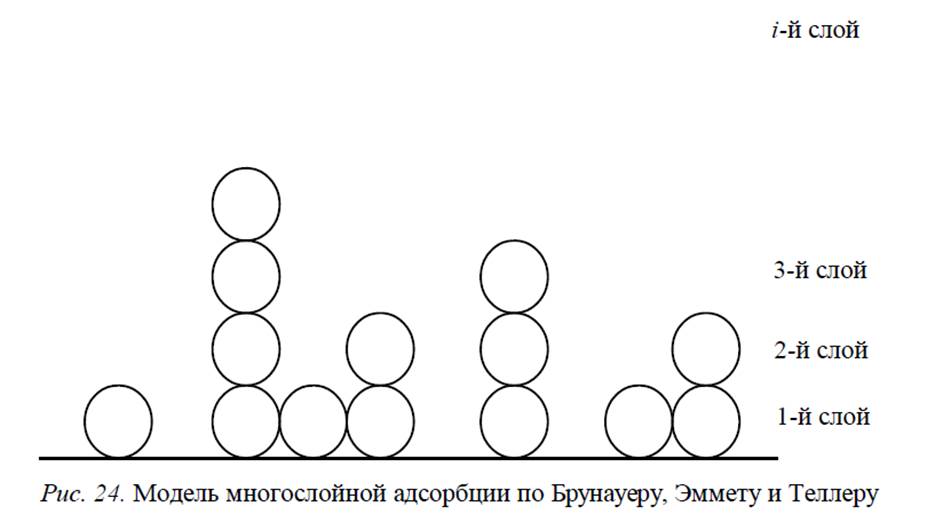
Теория БЭТ
Согласно Брунауеру, Эммету и Теллеру, состояние равновесия, достигаемое при некотором давлении, может быть формально опии-сано числом молекул, сконденсировавшихся на каком-либо одном центре.
Предполагается, что в каждом слое имеет место динамическое рав-новесие, т. е. число молекул, испаряющихся в 1 с, например, со слоя i, равно числу молекул, конденсирующихся в 1 с на (i – 1)-м слое.
 Обратный процесс – испарение –
требует активации, так как каж- дой молекуле необходимо получить от твердого
тела энергию (скажем, E1 на молекулу), достаточную для того, чтобы
преодолеть силу притя- жения ее к поверхности
Обратный процесс – испарение –
требует активации, так как каж- дой молекуле необходимо получить от твердого
тела энергию (скажем, E1 на молекулу), достаточную для того, чтобы
преодолеть силу притя- жения ее к поверхности
Недостатки:
§ Считали пов-ть однородной
§ Учитывали только вертик взаимодействие
§ Учитывали, что молекулы во всех слоях энергетически эквивалентны
§ Считали, что число адс слоев становится бесконечным
27. Адсорбция. Наружная и внутренняя поверхность. Классификация пор по размерам. Изотермы адсорбции.
Термин адсорбция был введен в 1881 году Кайзером для конден-сации газов на открытых поверхностях – в отличие от абсорбции га-зов, при которой молекулы газа проникают внутрь абсорбирующего твердого тела. Более широкий термин сорбция, предложенный Мак-Бейном в 1909 году, включает оба типа явлений – адсорбцию и аб-сорбцию.
Терминология
Адсорбция – самопроизв концентрир комп-тов из объема сопредельных фаз на межфазной пов-ти раздела.
Абсорбция – растворение в объеме конденсированной фазе.
Адсорбент – в-во, на кот происх адсорбц (H – host)
Адсорбат – адс-е в-во (G – guest)
Адсорбтив – еще не адсорбир G
Десорбция – удаление G из объёма или пов-ти H
Х-р взаимодействия H/G и G/G
Адсорбция вызывается действием силового поля у поверхности твердого тела (адсорбента), которое притягивает молекулы газа (ад-сорбата). Создаваемые твердым телом силы притяжения бывают в основном двух типов: физические и химические. Они обусловливают либо физическую (или ван-дер-ваальсову) адсорбцию, либо соответст-венно хемосорбцию.
Количество адсорбированного вещества, приходящееся на 1 г твер-дого тела, зависит от равновесного давления р, температуры Т, а также от природы газа и твердого тела. Следовательно,
x = f(p, T, газ, тв. тело).
Величина адсорбции х может быть измерена в любых подходящих единицах: граммах и миллиграммах, молях и миллимолях, кубических сантиметрах (объем, который адсорбированный газ занимал бы при нормальных температуре и давлении) и т. д.
Для данного газа, адсорбируемого при фиксированной температуре на данном твердом теле, уравнение принимает вид
x = f(p)T, газ, тв.тело.
Если температура газа ниже его критической температуры, т. е. он является паром, более удобна другая форма этого уравнения:
x = f(p/р0)T, газ, тв.тело,
где р0 – давление насыщенного пара адсорбата.
Данные уравнения представляют уравнения изотермы адсорбции, связывающие количество адсорбированного при фиксированной тем- пературе на данном твердом теле данного газа с его давлением.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.