







Термодинамический расчёт процессов с идеальной газовой углеводородной смесью.
Задание:
Газовую смесь в количестве 1 кг в распределительной газовой сети (в ёмкости хранения сжиженных нефтяных газов, в газовом пространстве резервуара для нефти) в зависимости от состава совершает термодинамические процессы от состояния 1 до состояния 2 с показателями n1 = 0; n2 = 0,2 ; n3 = 1,0 ; n4 = 1,15 ; n5 = К ; n6 = 1,55 . Объём газовой смеси во всех процессах изменяется в ε = V2/V1 = 0,6 раз. Смесь обладает свойствами идеального газа.
Начальное (в состояии 1) давление Р1 = 1,1·105 Па, начальная температура Т1 =325 К. Определить основные параметры газовой смеси в состоянии 1 (V1) и состоянии 2 (T2,V2, P2), изменение внутренней энергии (Δu), энтальпии (Δi), энтропии (ΔS) смеси, работу (I3, I0), внешнюю теплоту процесса (q), коэффициент распределения энергии в процессах (α).
Исходные данные для варианта 5 принять по двум последним цифрам шифра зачётной книжки по табл.2 и 3. Шифр 66.
Исходные данные: Состав газовой смеси по объёму,%
V(c3h8) – 0,5; V(c4h10) – 10; V(c5h12) – 4; V(c6h14) – 0,5; Vb – 85.
Порядок расчета политропного процесса
Молярная масса смеси, кг/кмоль
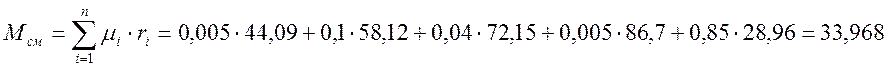
Газовая постоянная смеси, Дж/(кг·К)
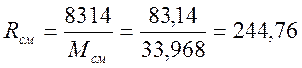
Т.к. рассматриваемый газ считается идеальным, можно для определения начального объёма использовать уравнение состояния:
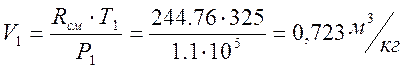
Параметры V1, T1 и Р1 для всех процессов будем считать начальными.
Из условия ε = V2/V1 = 0,6:
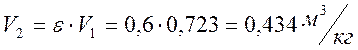
При n1 = 0 процесс является изобарным
Конечное давление P2 = P1 / εn = 1,1-105 Па
Конечная температура Т2 = Т1 -V2 / V1 = 325 - 0,6 =195 К
Теплоемкость смеси определяем по средней температуре процесса из графиков.
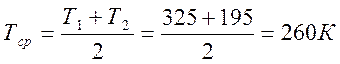
![]()
![]()
![]()
![]()
Для углеводородных газов tm= (t,+ t2)/2=195 К.
Воздух 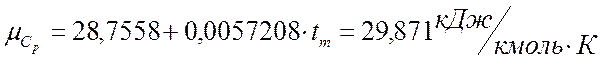
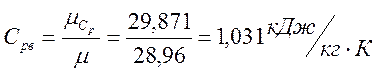
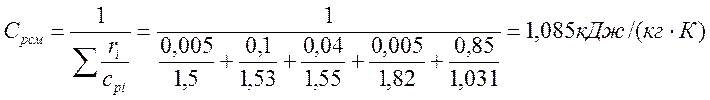
![]()
Термодинамическая работа
I=RCM · (Т2 - Т,) = 0,2448 · (195 - 325)= - 31,824 кДж/кг
Изменение внутренней энергии
ΔU=CVCM · (Т2- Т1) = 0,84 · (195-325)= -109,2 кДж/кг
Теплота процесса
qp= Cp· (Т2- Т1) = 1,085 · (195 - 325)= -141,05 кДж/кг
Изменение энтальпии
Δi = qp=-141,05 кДж/кг
Изменение энтропии
ΔS= Cp ·ln(V2/V1) = 1,085 · 1n 0,6 = -0,554 кДж/(кг-К)
Коэффициент распределения энергии
α = ΔU/ q = -109,2 / -141,05 = 0,774
Потенциальная работа
IП= I · n = 0
По первому закону термодинамики
q=I +ΔU= -31,824 – 109,2 = -141,024 кДж/кг - совпадение хорошее.
Относительная ошибка
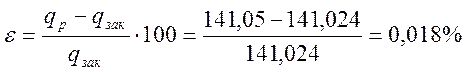
При n2=0,2 процесс является политропным
Конечное давление
P2 = P1 / εn =1,1·105/ 0,60,2 =1,218·105 Па
Конечная температура
Т2 = Т1 / εn-1 = 325 / 0,60,2-1 = 215,98 К
Термодинамическая работа
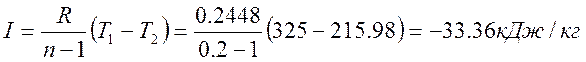
Изменение внутренней энергии
ΔU=CVCM · (Т2- Т1)= 0,84 • (215,98-325) = -91,577 кДж/кг
Изменение энтальпии
Δi = Cpсм • (Т2 – Т1)= 1,085 • (215,98 - 325)=-118,287 кДж/кг
Теплота процесса
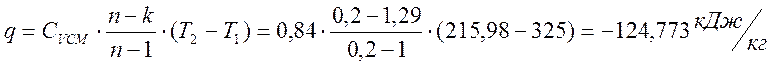
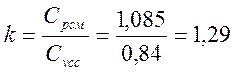
Изменение энтропии
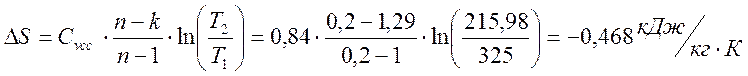
Коэффициент распределения энергии
α = ΔU/ q = -91,577 / -124,773 = 0,734
Потенциальная работа
IП= I · n = -33,36·0,2 = -6,672 кДж/кг
По первому закону термодинамики
q=I +ΔU= -33,36 – 91,577 = -124,937 кДж/кг
Относительная ошибка
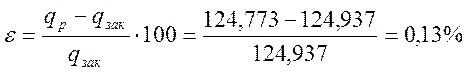
При n3= 1 процесс является изотермическим
Конечное давление
P2 = P1 / ε =1,1·105/ 0,6 =1,833·105 Па
Конечная температура
Т2 = Т1 =325 К
Термодинамическая работа
I = RCM · T · ln(ε) = 0,2448·325·ln 0,6 = -40,64 кДж/кг
Изменение внутренней энергии
ΔU=CVCM · (Т2- Т1)= 0 Дж/кг
Изменение энтальпии
Δi = Cpсм • (Т2 – Т1)= 0 Дж/кг
Теплота процесса
q=RCM · T · ln(ε)=0,2448·325·ln 0,6 = -40,64 кДж/кг
Изменение энтропии
ΔS = RCM · ln(ε) = 0,2448·ln 0,6 = -0,125 кДж/(кг-К)
Коэффициент распределения энергии
α = ΔU/ q =0
Потенциальная работа
IП= I · n = -40,64·1 = -40,64 кДж/кг
Относительная ошибка
ε = ( q – l ) · 100% / q = 0%
При n4 = 1,15 процесс является политропным
Конечное давление
P2 = P1 / εn =1,1·105/ 0,61,15 =1,979·105 Па
Конечная температура
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.