ЛАБОРАТОРНАРОБОТА6
ВИЗНАЧЕННЯ ІЗОЕЛЕКТРИЧНОЇ КРАПКИ БІЛКУ (ІКБ)
Мета: дослідження стійкості білкових розчинів; визначення ІКБ.
Короткі теоретичні положення
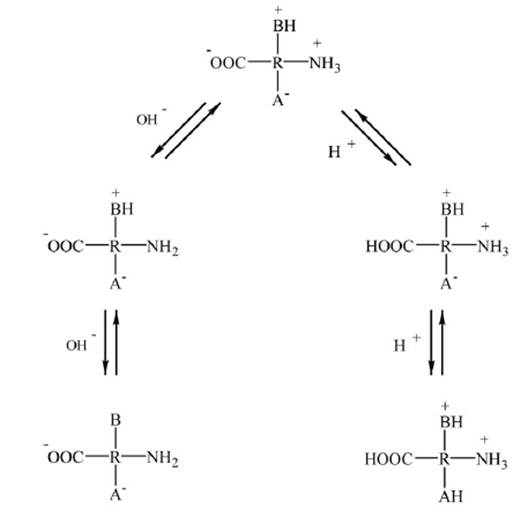
У кислому і лужному середовищах молекули білка мають некомпенсовані заряд, що розподілені по всій довжині молекули. Такі молекули, витягнуті у вигляді ниток, не можуть об'єднуватися в агрегати і згортатися в щільні клубки. У ізоелектричному стані негативні і позитивні заряди молекули білку скомпенсовані і в цьому стані молекули електро нейтральні. У цьому стані молекули білка згортаються в щільні клубки і здатні об'єднуватися у великі агрегати, що випадають в осад. У такому стані властивості білкового розчину (набухання, світлорозсіювання, осмотичний тиск, в'язкість) мають мінімальні значення, а оптична густина, показник заломлення - максимальні. Ізоелектричну крапку білку (ІКБ) визначають експериментально, виявляючи залежність зазначених властивостей від рН білкового розчину: положення мінімуму або максимуму на відповідні графіках відповідає ІТБ.
Необхідні реактиви, посуд та обладнання: рН-метр; секундомір; технічні ваги; мірні колби на 50 см3 - 8 шт.; піпетки на 5 і 10 см3; циліндр на 50 см3; водяна баня; ступка фарфорова; термометр; фільтрувальний папір; казеїн; розчин желатину 1%; CH3COOH (1,0; 0,1; 0,01 моль/дм3); СH3COONa (1,0 моль/дм3); розчини HCI та NaOH (0,1 моль / дм 3).
Методика виконання роботи
I. Визначення ізоелектричної крапки казеїну методом візуального спостереження
Визначення ІК казеїну в даній роботі ґрунтується на експериментальному виявленні зв'язку між рН білкового розчину і його прозорістю. З цією метою готується серія розчинів казеїну з різним вмістом СН3СООН, що забезпечує різні значення рН в цих розчинах. Шляхом зіставлення візуальних спостережень за прозорістю розчинів зі значеннями їх рН, виміряними за допомогою рН-метра, визначають інтервал рН, в якому знаходиться ІКБ.
Приготування вихідного розчину казеїну.
1. Роботу проводять з 1% водним розчином желатину, який розчиняють в гарячій воді, фільтрують крізь паперовий фільтр і охолоджують до кімнатної температури.
2. У мірну колбу на 50 см3 внесіть 25см3 розчину желатину.
3. За допомогою піпетки введіть в колби відповідні кількості кислоти та лугу як це вказано в таблиці 1.
4. Потім суміші обережно перемішуйте.
Приготування робочих розчинів.
Таблиця 1.Об’єм розчинів кислоти та лугу, що додають до розчинів желатину, та встановлений при цьому рН
|
№ колби |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Об’єм 0,1 М HCIмл |
2 |
1,3 |
0,9 |
0,65 |
0,25 |
|||
|
Об’єм 0,1 NaOH мл |
- |
- |
- |
- |
- |
- |
0,24 |
0,38 |
|
рН |
2 |
3 |
3,5 |
4 |
4,5 |
5 |
7 |
9 |
|
Прозорість Оптична густина |
ІІ.Визначення ізоелектричної точки желатину.
1. Через 10 хвилин у кожному з приготованих розчинів визначте рН за допомогою рН-метра
2. Прозорість розчинів (якщо є осад - «+», якщо немає осаду «-») визначте візуально або за допомогою ФЕК.
3. Результати вимірювань і спостережень внесіть в табл.
4. Побудуйте графік залежності оптичної густини розчину від рН.
Запишіть відповідні висновки за виконану роботу.
Виконайте завдання для самостійної роботи.
1. Які речовини називаються поліелектролітами?
2. На які групи діляться поліелектроліти?
3. До якої групи поліелектролітів відносяться білки?
4. Як дисоціює молекула білка в кислому і лужному середовищах?
5. Що називається ізоелектрична станом і ІТБ?
6. На чому засновані методи визначення ізоелектричної точки білка?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.