1.2
|
Тема |
Література |
|
Хімічна кінетика та каталіз Конспектування основних моментів теми |
И.С.Галинкер, П.И. Медведев. Физическая и коллоидная химия. «Высшая школа», М: 1972г с. 35-40, с.137-167 |
Хімічна кінетика –розділ хімії, що вивчає перебіг хімічних процесів за певний час.
Реакції можуть бути гомогенними і гетерогенними. Гомогенні реакції протікають в однорідному середовищі (наприклад, у газовій фазі,чи рідкому розчині). Гетерогенні реакції протікають у неоднорідному середовищі – між речовинами. Які знаходяться в різних фазах.
Швидкість хімічної реакції (у випадку гомогенних реакцій) визначають як зміну концентрацій реагуючих речовин або продуктів реакції за одиницю часу, чи на одиниці поверхні поділу фаз (у випадку гетерогенних реакцій).
Залежність швидкості реакції від концентрації реагуючих речовин. Закон діючих мас.
При постійній температурі швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин, в ступенях, рівних стехіометричним коефіцієнтам у рівнянні реакції.
Наприклад:
О2 + 2NO = 2NO2 u = k× C2 (NO) × C (О2)
Залежність швидкості реакції від температури. Енергія активації.
Відповідно правилу Вант-Гоффа, сформульованого на основі дослідних даних, для більшості хімічних реакцій швидкість збільшується приблизно в 2¸4 рази при підвищенні температури на кожні 10 градусів.
u t = u0 × g Dt/10 , де g = 2¸4 – температурний коефіцієнт реакції.
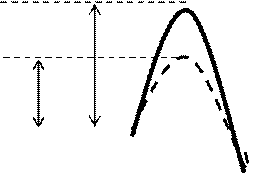
Енергія, необхідна для переходу речовин у стан активованого комплексу, називається енергією активації Еа (чи энтальпією активації DНа ).
![]() Е К
Е К
 |
Е2 Е1
![]()
![]() І
І
ІІ
Хід реакції
Рисунок 2. Утворення проміжного активованого комплексу в реакції .
Е1- енергія дисоціації молекули Н2, І2 на атоми;
Е2 – енергія утворення активованого проміжного комплексу;
І – початковий стан системи; ІІ – кінцевий стан системи.
Вплив каталізатора на швидкість хімічної реакції.
Одним з розповсюджених у хімічній практиці методів прискорення хімічних реакцій є каталіз. Каталіз – це прискорення хімічної реакції речовиною каталізатором, що активно бере участь у проміжних стадіях реакції, але вихідним з цієї реакції хімічно незмінні.
Хімічна рівновага
Швидкість прямої реакції uпрямої = k1CAaCBb. В міру витрати вихідних речовин швидкість
прямої реакції зменшується.
Швидкість зворотної реакції uзворотної = k2CDd CEe. У міру нагромадження продуктів реакції швидкість зростає.
Через якийсь час t швидкості прямої і зворотної реакцій стануть рівні, що відповідає стану хімічної рівноваги.
Стан рівноваги є динамічним, рухливим
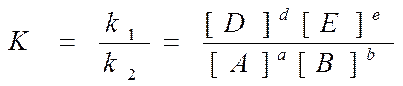 |
В умовах рівноваги uпрямої = uзворотної, з чого випливає, що відношення констант швидкостей прямої і зворотної реакцій є величина постійна:
Величину К – називають константою рівноваги. Ця величина не немає розмірності, але концентрації обов'язково молярні (моль/л). Вона характеризує глибину протікання реакції. Залежить від природи реагуючих речовин і температури. Вона зв'язана зі зміною стандартної енергії Гиббса рівнянням: DG0 = -RT ln.К
Зміщення хімічної рівноваги
Оскільки хімічна рівновага рухливий процес, то при зовнішніх змінах (зміна С, р,Т) рівновага також порушується, концентрація всіх речовин в системі буде змінюватися до тих пір , поки не встановиться нове положення рівноваги. Якщо зовнішній вплив прибрати, то система повертається в початковий стан.
Принцип Ле-Шательє. Якщо на систему, що знаходиться в стані рівноваги подіяти зовнішнім фактором, то рівновага зміститься в бік тієї реакції , яка зменшить вказану дію.
Отже: Підвищення тиску в газоподібних системах призводить до зміщення рівноваги в бік утворення тих речовин, які займають менший об’єм. Якщо об’єм системи при реакції не змінюється , то тиск не впливає на стан рівноваги.
При підвищенні температури рівновага системи, що перебувають в стані рівноваги, зміщується у напрямку ендотермічної реакції, а при зниженні у напрямку екзотермічних реакцій.
Вплив каталізатора. Каталізатор прискорює однаково як пряму так і зворотну реакції, тому на вихід реакції він не впливає, але скорочує час встановлення рівноваги.
2. Термінологічний словник
Хімічна кінетика –розділ хімії, що вивчає перебіг хімічних процесів за певний час.
Енергія, необхідна для переходу речовин у стан активованого комплексу, називається енергією активації Еа (чи энтальпією активації DНа ).
Величину К – називають константою рівноваги
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.