_2.3
|
Тема |
Література |
|
Буферні системи Конспектування основних моментів теми. Виконання домашніх завдань по темі. |
Стромберг А. Г., Семченко Д.П. Физическая химия.–М.: Высш. шк., 1988 |
Зміна рН грунтів, як вже згадувалося має велике значення для розвитку та росту рослин. Речовини, що потрапляють в грунт з добривами, ядохімікатами, тощо здатні зсувати рН грунтів. Так суперфосфат , що містить кислу сіль- дигідрофосфат кальцію здатний підвищувати кислотність грунту, а така сіль як поташ – навпаки зменшує кількість іонів водню. Наявність в грунті солей слабких кислот таких як гідро карбонат кальцію, обумовлює здатність грунту протидіяти як підкисленню так і підлужінню грунтів. Таки ж властивості мають грунтові колоїди.
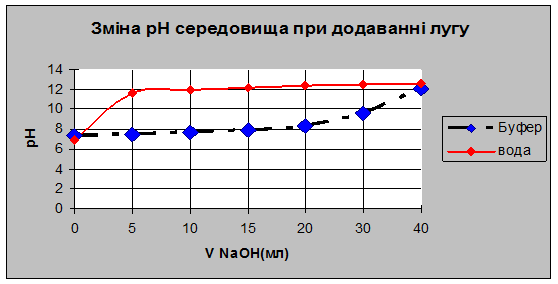
Розчини, які мають властивість підтримувати в певних межах величину рН сталою при додаванні до них кислот, лугів, а також при розведенні , називають буферними .
Найчастіше буферні системи – це розчини слабкої кислоти і добре дисоційованої солі цієї кислоти або розчин слабкої основи і добре дисоційованої солі цієї основи.
|
Кислий буфер |
Основний буфер |
|
Слабка кислота (СН3СООН) Сіль цієї кислоти, що добре дисоціює (СН3СООNa) |
Слабка основа (NH4OH) Сіль цієї основи, що добре дисоціює (NH4Cl) |
2. Розглянемо механізм дії буферної системи на прикладі ацетатного буферного розчину , що складається з слабкої оцтової кислоти та ацетату натрію (кислий буфер).
В розчині ацетат натрію , як сильний електроліт повністю дисоціює :
СН3СООNaÛCH3COO- + Na+
Оцтова кислота - слабка. Але в незначній мірі дисоціює на іони:
CH3COOHÛ CH3COO- + H+
При наявності сильного електроліту – ацетату натрію утворюється велика кількість ацетат іонів, і як наслідок дисоціація кислоти дуже гальмується. Тому в розчині оцтова кислота перебуває майже вся в молекулярній формі.
Якщо до такого розчину додати соляну кислоту, то вільні іони водню цієї кислоти зв’яжуться з аніонами СН3СОО- і утвориться недисоційовані молекули оцтової кислоти.
Н+ + СН3СОО- Û CH3COOH
Отже, при додаванні соляної кислоти концентрація іонів водню в розчині практично не змінюються
Якщо до цього буферного розчину добавляти їдкий натр NaOH, то він як сильний електроліт повністю дисоціює :
NaOH Û Na+ + OH-
Na+ + OH- + H+ + CH3COO- Û H2O + CH3COONa
У міру того як іони ОН зв’язуватимуться з іонами Н+, оцтова кислота дисоціюватиме і концентрація іонів Н+ , а відповідно і величина рН майже не зміниться. Буферна дія такої системи буде працювати доки не прореагує вся оцтова кислота. Після цього додавання навіть незначних кількостей лугу буде викликати різке збільшення рН.
3. Крім розглянутого прикладу буферну дію має також аміачна буферна система , що складається з слабкої основи NH4OH та її солі NH4Cl– сильного електроліту (основний буфер).
Скорочено буферну дію аміачного буфера можна представити:
NH4OH + H+ Û NH4+ + H2O
![]() NH4+
+ Cl- + OH- Û NH4OH + Cl-
NH4+
+ Cl- + OH- Û NH4OH + Cl-
Прикладом буферних систем може бути :
Карбонатна (H2CO3, NaHCO3);
Фосфатна (NaH2PO4, Na2HPO4);
Гемоглобінова
4. Для розрахунку концентрації іонів водню в буферній системі, що складається з слабкої кислоти та її солі розглянемо процес дисоціації слабкої кислоти: CH3COOHÛ CH3COO- + H+
На основі закону діючих мас для рівноважних процесів константа дисоціації дорівнює:
[H+] × [CH3COO-]
К =----------------------
[CH3COOH]
де К – константа дисоціації кислоти при 22 С , дорівнює 1,8* 10-5 ; Звідси :
К × [CH3COOH]
[H+] =----------------------
[CH3COO-]
В загальному вигляді для буферної системи (кислий буфер):
Ккислоти × [кислоти]
[H+] =-----------------------------
[солі]
Прологарифмувавши рівняння (9) одержуємо вираз для розрахунку рН середовища:
[кислоти]
рН = pKкислоти – lg -----------
[солі]
В буферних системах, що складаються з слабкої основи та її солі (основний буфер) розрахунок концентрації іонів водню та реакції середовища в загальному вигляді можна записати так:
Коснови × [основи]
[ОH-] =-------------------------
[солі]
[основи]
рОН = pKоснови – lg -----------
[солі]
[основи]
рН =14 - pKоснови + lg -----------
[солі]
5. Для кількісної характеристики буферних властивостей розчину введено величину, яку називають буферною ємністю. Буферна ємність дорівнює кількості грам-еквівалентів кислоти або лугу, яку треба додати до 1л буферного розчину, щоб змінити рН на одиницю. Величина буферної ємності залежить від концентрації компонентів буферної системи. Найбільша величина буферної ємності досягається в розчинах, у яких концентрація слабкої кислоти або слабкої основи дорівнює концентрації солі.
Буферна ємність розраховується за формулою :
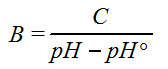 , де С- кількість в
моль-екв. сильної кислоти чи сильного лугу, рН – водневий показник після
додавання кислоти чи лугу, рН0 – водневий
показник до додавання кислоти чи лугу.
, де С- кількість в
моль-екв. сильної кислоти чи сильного лугу, рН – водневий показник після
додавання кислоти чи лугу, рН0 – водневий
показник до додавання кислоти чи лугу.
Приклади задач.
1. Визначити [Н+] та рН ацетатного буферного розчину, що складається з 0,01 М розчину оцтової кислоти та ацетату натрію Кк=1,8 ×10-5; рК = 4,74
По формулі Кк × [CH3COOH] 1,8 10-5 × 0,01
[H+] =---------------------- =---------------- = 1,8× 10-5
[CH3COO-] 0,01
[кислоти]
рН = pKкислоти – lg ----------- = 4,74 – lg(0,01/0,01)=4,74
[солі]
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.