CnHm + (m + -JL) 02 - mCO2 + -|- H20;
а также восстановление окиси азота продуктами неполного сгорания топлива, главным образом окисью углерода 2NO + 2СО -> N2 + 2СО2.
Кроме того, между компонентами ОГ и кислородом может протекать целый ряд .побочных реакций, в частности
СО + Н2О 5t СО2 + Н2;
5/2Н2 + NO :£ NH3 + Н20;
NH3 + 5/4О2 ^ NO + 3/2Н2О;
H2 + NO^ H2O+1/2N2;
Н2 + l/2Oa 5S Н2О
и некоторые другие.
Термодинамический расчет показывает, что при температурах до 1000° С реакции протекают в направлении формирования нетоксичных соединений, что сопровождается большим изменением свободной энергии [52].
Однако при относительно невысоких температурах в выпускном тракте ДВС (300—800° С) скорость этих процессов невелика, и за время пребывания в системе выпуска состав газов изменяется незначительно. Для 'ускорения протекающих реакций используют катализаторы, которыми являются вещества, способные увеличивать скорость реакции, (Приводящей к получению желаемого продукта 125]. При этом количество вещества катализатора остается неизменным.
Наиболее важные параметры любого катализатора — активность и селективность. Активность — способность катализатора инициировать тот или иной химический процесс. Она обычно характеризуется степенью превращения реагирующих компонентов (реактантов) при определенной температуре:
■П = Ас/с0.
Для составления различных катализаторов и оценки изменения их эффективности в процессе работы обычно используют зависимость между степенью превращения и температурой (рис. 1) или температурой Тх, при которой достигается заданная степень превращения. Чем больше кривая xT = f(T) сдвинута влево, тем эффективнее протекают каталитические процессы на режимах, характеризуемых низкой температурой отработавших газов. К таким режимам относятся режимы работы при прогреве двигателя и на холостом ходу. Обычно на этих режимах отработавшие газы характеризуются повышенной концентрацией окиси углерода и углеводородов.
Целесообразно отдельно рассмотреть такой параметр каталитического процесса, как объемная скорость, которая определяет
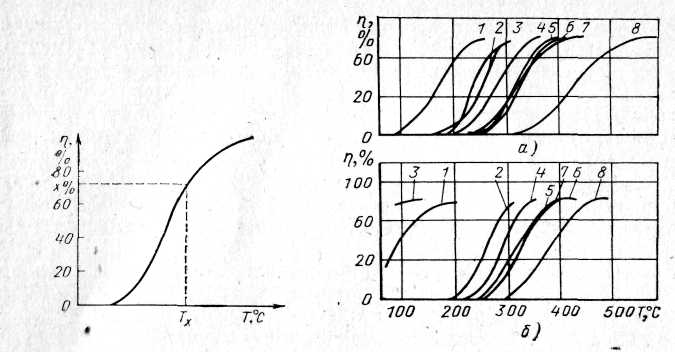
Рис. 1. Степень превращения реагентов на поверхности катализатора в зависимости от температуры реакции
Рис. 2. Степень превращения окиси углерода, углеводородов и водорода на поверхности катализатора в зависимости от температуры реакции:
Л — катализаторы окисного типа; б — катализаторы на благородных металлах* / — СО" 2-С2Н,; 3 — Н2; 4 - С3Н6; 5 — С,Н10; 6 - С2Н6; 7 — С3Нв; в — СН,
удельную газовую нагрузку на катализатор и представляет собой отношение приведенного к нормальным условиям объема газовой смеси, прошедшей через катализатор за 1 ч, к насыпному объему катализатора. Иногда вместо объемной скорости используют время пребывания, т. е. время прохождения через катализатор объема газов, равного объему катализатора,
т = 3600/V.
Чем меньше время пребывания, тем большее количество газа по объему может быть обработано на катализаторе в единицу времени.
Термин селективность характеризует способность катализатора из нескольких возможных реакций ускорять те, которые ведут к достижению желаемого результата. В рассматриваемом случае под понятием селективность подразумевается активирование только тех реакций между компонентами отработавших газов и кислородом, в результате которых получают нетоксичные соединения.
Механизм каталитического окисления окиси углерода и углеводородов на катализаторах сложен i[4, 25]. В основе процессов, протекающих на катализаторах, лежат процессы автоматизации и ионизации кислорода, после чего его способность химически взаимодействовать с окисью углерода и углеводородами резко возрастает.
Важным критерием, определяющим скорость окисления, является также энергия межатомной связи. Чем она ниже, тем при более низких температурах достигается заданная степень "превраще-
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.