Используя полученные в эксперименте данные, определяем температуру
Т = 273+19,3=292,3 К
Т = 273+19,5=292,5 К
Т = 273+19,8=292,8 К
Т = 273+20,2=293,2 К
Т = 273+20,8=293,8 К
Т = 273+22,3=295,3 К
Абсолютное давление подсчитывается по формуле
Рa = В+ Ризб
Pa – абсолютное давление, кПа;
B – барометрическое давление, кПа;
Pизб – избыточное давление, кПа.
Pa1 = 101,1кПа;
Paа = 101,1+23,5=124,6 кПа;
Paб = 101,1+51=152,1 кПа;
Paв = 101,1+98,1=199,2 кПа;
Paг = 101,1+176,2=277,6 кПа;
Pa2 = 101,1+345,1=446,2 кПа.
Находим объём воздуха в баллоне по формуле:
![]()
V – объем воздуха в баллоне, м3;
R – радиус баллона, м;
H – высота воздушного столба, м.
![]() м3;
м3;
![]() м3;
м3;
![]() м3;
м3;
![]() м3;
м3;
![]() м3;
м3;
![]() м3;
м3;
Из уравнения состояния находим массу воздуха в цилиндре:
![]() ;
;
m – масса воздуха в баллоне, кг;
R – газовая постоянная воздуха, кДж/(кг∙К).
![]() ;
;
μ – молярная масса воздуха, равная 28,96 кг/моль.
R = 8,314/28,96 = 0,287 кДж/(кг∙К)
m=101,1*0,062/0,287*292,3=0,0738кг.
Удельный объем воздуха для каждого измерения определяется из соотношения
![]()
![]() - удельный объем воздуха, м3/кг;
- удельный объем воздуха, м3/кг;
v1=0,062/0,0738=0,829м3/кг
vа=0,052/0,0738=0,702м3/кг
vб=0,042/0,0738=0,575м3/кг
vв=0,033/0,0738=0,447м3/кг
vг=0,024/0,0738=0,32м3/кг
v2=0,014/0,0738=0,191м3/кг
Энтропия
![]()
Срm – средняя массовая изобарная теплоемкость воздуха, кДж/(кг*К),
![]()
![]() - принимается равной 1,297;
- принимается равной 1,297;
![]() кДж/(кг*К),
кДж/(кг*К),
S1 = 1,003*Ln292,3/273 – 0,287*Ln101,1/101,3+1 = 1,07 кДж/(кг*К),
S1 =1,003*Ln292,5/273 – 0,287*Ln124,6/101,3+1 = 1,011 кДж/(кг*К),
S1 =1,003*Ln292,8/273 – 0,287*Ln152,1/101,3+1 = 0,954 кДж/(кг*К),
S1 = 1,003*Ln293,2/273 – 0,287*Ln199,2/101,3+1 = 0,877 кДж/(кг*К),
S1 = 1,003*Ln293,8/273 – 0,287*Ln277,6/101,3+1 = 0,787 кДж/(кг*К),
S1 = 1,003*Ln295,3/273 – 0,287*Ln446,2/101,3+1 = 0,653 кДж/(кг*К),
Политропный процесс:
Уравнение политропного процесса Рυn = const. Показатель политропного процесса n определяют по выражению
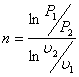
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.