 1.
Электрохимия. Уравнение Нернста.
1.
Электрохимия. Уравнение Нернста.
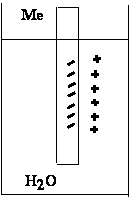
Если любой металл (Al, Fe) опустить в воду, то часть ионов металла с поверхности перейдет в воду.
Me0-2e=Me4+
На поверхности раздела фаз возникает двойной электрический слой, обладающий определенным значением электронного потенциала.
Скорость растворения у разных металлов разная.
Если металл опускать раствор своей соли, то получится следующее:
1)  для активных металлов (стоящие до
водорода) наблюдается та же картина: пластина заряжена отрицательно, часть
ионов переходит в воду.
для активных металлов (стоящие до
водорода) наблюдается та же картина: пластина заряжена отрицательно, часть
ионов переходит в воду.
DGраств<0
Энергия гидротации больше, чем работа выхода ионов на поверхности металла.
Zn0-2e=Zn2+
восст. окисл.
2) для металлов за водородом, энергетически более выгоден следующий процесс: ионы металла из раствора внедряются в кристаллическую структуру металла, заряжая его положительно.
 |
Cu2++2e=Cu0
В обоих случаях на границах раздела фаз возникает электронный потенциал. Его величина зависит от:
Влияние этих факторов описывается уравнением Нернста:
восстановительную форму одного и того же элемента.
 |
2. Закон эквивалентов.
Все вещества реагируют друг с другом в количествах, равных или пропорциональных их химическим эквивалентам.
Химическим эквивалентом называется такое весовое количесвто, которое без остатка взаимодействует с 1г. водорода или же вытесняет такое количество водорода из кислоты.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.