Тепловой эффект реакции равен разности сумм теплот сгорания реагентов и продуктов с учетом стехиометрических коэффициентов, стоящих в уравнении.
DH0р-ции=ånjDH0сгор.реагенты-åniDH0сгор.продукты
Тепловой эффект реакции одинаков, является постоянным, рассчитать его можно двумя способами. В зависимости от того, какие данные имеются.
2. Растворимость газов в жидкости.
1. Влияние давления
Закон Генри: растворимость газа в жидкости прямо пропорциональна парциальному давлению газа.
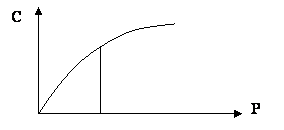 С=2P
С=2P
2. Влияние температуры на растворимость газа в жидкости
Процесс растворения обычно сопровождается выделением тепла. С ростом температуры растворимость уменьшается.
dLnK/dT=DH/RT2
 3. Влияние нелетучих компонентов
3. Влияние нелетучих компонентов
Согласно признаку Ле Шателье, добавление нелетучего компонента приводит к уменьшению растворимости газа в жидкости.
Равновесие смещается в том направлении, в котором ослабляется приложенное воздействие, которое уменьшает концентрацию кислорода в воде, за счет его испарения.
 (P01-P02)/P1=h2
(P01-P02)/P1=h2
Рассмотрим чистый растворитель – вод. При определенной температуре на поверхности растворителя наступает момент динамического равновесия, при котором скорость испарения молекул воды равна скорости конденсации. Если в чистый растворитель добавить неэлектролит, то равновесие будет нарушено (концентрация воды в растворе станет меньше). Система отреагирует следующим образом: часть молекул воды из газообразной фазы перейдет в жидкую до тех пор, пока не восстановится равновесие.
Закон Рауля: относительное понижение P01 (давление насыщенного пара раствора над читсым растворителем) прямо пропорционально мольной доле растворенного вещества.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.