 |
|||
|
|||
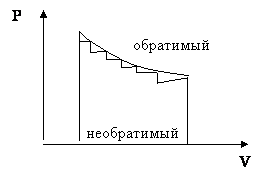
1. Обратимый процесс – такое превращение, если система бесконечно медленно переходит из одного состояния равновесия в другое через промежуток равновесных состояний.
При этом параметр системы и окружающей среды отличается друг от друга на бесконечно малую величину.
Система находится в состоянии равновесия, если значение параметров одинаково во все точках и остается фиксированным, т.е. неизменным во времени.
При этом одновременно осуществляется термическое равновесие, механическое равновесия (давление) и химическое (состав).
Pвнутр=Pвнеш
A=v1òV2PвнешdT= - Pвнеш(V2-V1)
2. Необратимый процесс.
Pвнутр ¹Pвнеш
PV=nRT
P=nRT/V
A= - v1òV2nRTdv/v= - nRTLnv2/v1
Т.о. величина A зависит от пути процесса (обратимого или необратимого), поэтому А не является функцией состояния и её бесконечно малые изменения обозначаются: dA.
1 закон термодинамики. Подводящееся к системе тепло тратится на изменение внутренней энергии системы и на совершение работы.
DU=A+Q
|
|
||||
 |
||||
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.