1 РАСЧЁТНАЯ ЧАСТЬ
1.1 Расчёт горения топлива
Целью расчета горения топлива является определение:
- теплоты сгорания
топлива (![]() );
);
- теоретического (![]() ) и действительного (
) и действительного (![]() ) количества воздуха;
) количества воздуха;
- теоретического (V0) и действительного (Vд) количества продуктов сгорания;
- состава и плотности продуктов сгорания;
- температуры горения.
Состав сухих газов возьмём из справочника [1] для КМК:
Таблица 1 - Состав сухих газов
|
Компонент |
СО |
Н2 |
СН4 |
С2H6 |
СО2 |
N2 |
О2 |
Σ, % |
|
Коксовый газ |
7,44 |
56,42 |
26,05 |
3,14 |
2,35 |
3,90 |
0,63 |
100 |
|
Доменный газ |
28,50 |
2,50 |
0,10 |
- |
10,70 |
58,10 |
- |
100 |
Пересчитаем состав газа на влажный по формуле:
![]() , (1)
, (1)
где ![]() - содержание компонента во
влажном газе, об.%;
- содержание компонента во
влажном газе, об.%;
К - коэффициент пересчёта с сухого газа на влажный;
![]() -
содержание компонента в сухом газе, об.%.
-
содержание компонента в сухом газе, об.%.
Рассчитаем коэффициент пересчета К по формуле:
![]() , (2)
, (2)
где ![]() - содержание влаги во
влажном газе, об.%.
- содержание влаги во
влажном газе, об.%.
Рассчитаем содержание влаги ![]() по формуле:
по формуле:
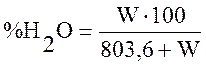 , (3)
, (3)
где W - содержание влаги во влажном газе, г/м3;
W=10…50 г/м3, принимаем W=35 г/м3.
По формуле (3) определяем содержание
влаги ![]()
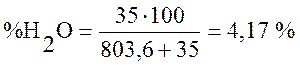 .
.
По формуле (2) определяем коэффициент пересчёта К
![]() .
.
Используя данные таблицы 1 пересчитаем состав сухого коксового газа на влажный по формуле (1):
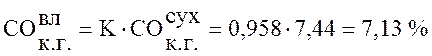 ,
,
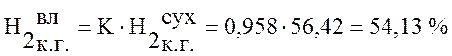 ,
,
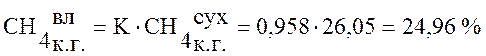 ,
,
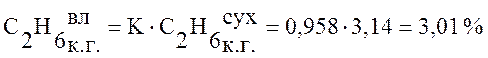 ,
,
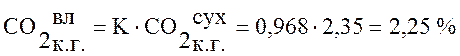 ,
,
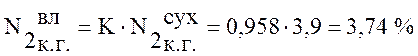 ,
,
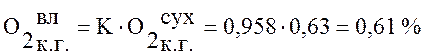 .
.
Используя данные таблицы 1 пересчитаем состав сухого доменного газа на влажный по формуле (1):
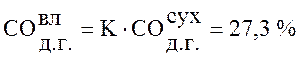 ,
,
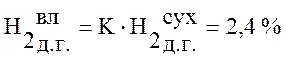 ,
,
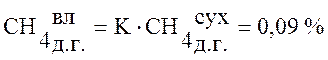 ,
,
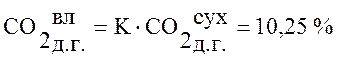 ,
,
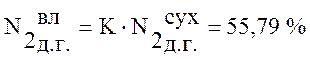 .
.
Результаты расчётов сведём в таблицу:
Таблица 2 - Состав влажных газов
|
Компонент |
СО |
Н2 |
СН4 |
С2H6 |
СО2 |
N2 |
О2 |
H2O |
Σ, % |
|
Коксовый газ |
7,13 |
54,13 |
24,96 |
3,01 |
2,25 |
3,74 |
0,61 |
4,17 |
100 |
|
Доменный газ |
27,30 |
2,40 |
0,09 |
- |
10,25 |
55,79 |
- |
4,17 |
100 |
Рассчитаем состав смешанного газа по формуле:
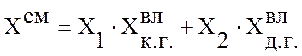 , (4)
, (4)
где ![]() - содержание компонента в
смеси, об.%;
- содержание компонента в
смеси, об.%;
![]() ,
, ![]() - доли коксового газа и доменного
газа в смеси;
- доли коксового газа и доменного
газа в смеси;
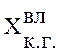 -
содержание компонента во влажном коксовом газе, об.%;
-
содержание компонента во влажном коксовом газе, об.%;
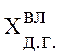 -
содержание компонента во влажном доменном газе, об.%;
-
содержание компонента во влажном доменном газе, об.%;
![]() =0,6;
=0,6;
![]() =0,4 (по условию задания).
=0,4 (по условию задания).
Используя данные таблицы 2 определим состав смешанного газа по формуле (4):
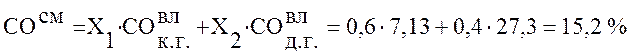 ,
,
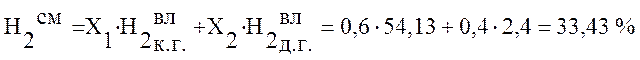 ,
,
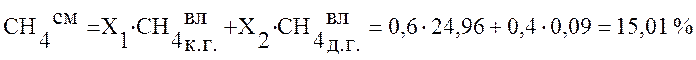 ,
,
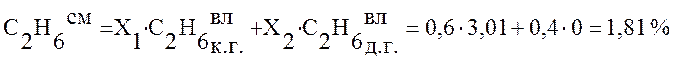 ,
,
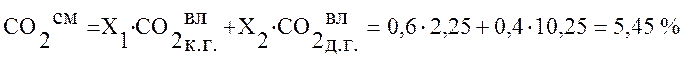 ,
,
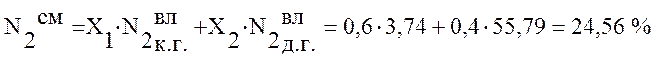 ,
,
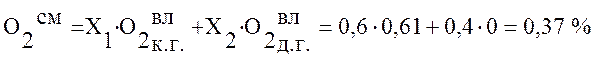 ,
,
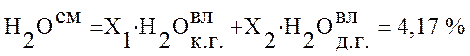 .
.
Результаты расчета сведём в таблицу:
Таблица 3 - Состав коксодоменной смеси
|
Компонент |
СО |
Н2 |
СН4 |
С2H6 |
СО2 |
N2 |
О2 |
H2O |
Σ, % |
|
Коксодоменная смесь |
15,20 |
33,43 |
15,01 |
1,81 |
5,45 |
24,56 |
0,37 |
4,17 |
100 |
Расчёт горения топлива ведём в табличной форме
Таблица 4 - Расчёт горения топлива на 100 м3
|
Участвуют в горении |
Образуется продуктов сгорания |
|||||||||
|
Топливо |
Реакция горения |
Окислитель |
СО2 |
H2O |
О2 |
N2 |
Всего |
|||
|
Компоненты |
Содержание, % |
О2 |
N2 |
Всего |
||||||
|
СО |
15,20 |
СО+1/2∙О2=СО2 |
7,6 |
226,89 |
287,2 |
15,2 |
- |
- |
251,45 |
15,2 |
|
Н2 |
33,43 |
Н2+1/2∙О2=H2O |
16,72 |
- |
33,43 |
- |
33,43 |
|||
|
СН4 |
15,01 |
СН4+2∙О2=СО2+2∙H2O |
30,02 |
15,01 |
30,02 |
- |
45,03 |
|||
|
С2H6 |
1,81 |
С2H6+7/2∙О2=2∙СО2+3∙H2O |
6,34 |
3,62 |
5,43 |
- |
9,05 |
|||
|
СО2 |
5,45 |
СО2→СО2 ДЫМ |
- |
5,45 |
- |
- |
5,45 |
|||
|
N2 |
24,56 |
N2→N2 ДЫМ |
- |
- |
- |
- |
251,45 |
|||
|
О2 |
0,37 |
- |
-0,37 |
- |
- |
- |
- |
|||
|
H2O |
4,17 |
H2O→H2O ДЫМ |
- |
- |
4,17 |
- |
4,17 |
|||
|
Σ |
100 |
n=1 |
60,31 |
226,89 |
287,2 |
39,28 |
73,05 |
- |
251,45 |
363,78 |
|
n=1,1 |
66,34 |
249,58,7 |
315,92 |
39,28 |
73,05 |
6,03 |
274,14 |
392,5 |
||
|
% |
21 |
79 |
100 |
1 |
18,61 |
1,53 |
69,84 |
100 |
||
Используя данные таблицы 3 произведём следующие расчёты:
Теоретическое количество воздуха, необходимого для сжигания топлива:
![]() .
.
Действительное количество воздуха с учётом избытка окислителя:
![]() .
.
Теоретическое количество дыма, образующееся при сгорании топлива (смеси):
![]() .
.
Действительное количество дыма:
![]() .
.
Низшая теплота сгорания газообразного топлива рассчитывается по формуле:
![]() . (5)
. (5)
Тогда для коксового газа:
![]() .
.
Для доменного газа:
![]() .
.
Для смешанного газа:
![]() .
.
Плотность продуктов сгорания определяется по формуле:
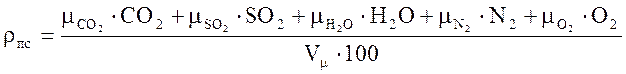 , (6)
, (6)
где ![]() и
т.д. - молекулярные массы составляющих дыма, кг/кмоль;
и
т.д. - молекулярные массы составляющих дыма, кг/кмоль;
СО2 и т.д. - содержание составляющих дыма, %;
vμ - объем 1 кмоля газа при нормальных условиях;
vμ=22,4 м3/кмоль.
Рассчитаем по формуле (6) плотность продуктов сгорания:
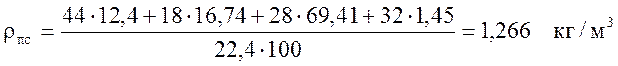 .
.
Аналогично определяется плотность газообразного топлива
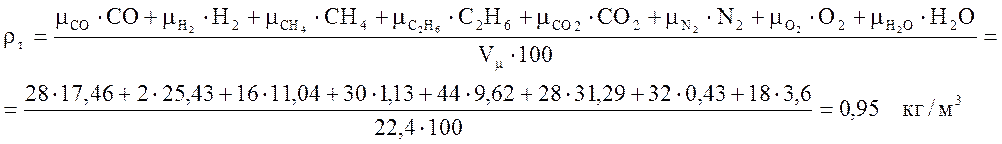
и плотность сухого воздуха
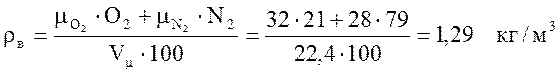 .
.
Правильность расчета горения проверяется составлением материального баланса: масса исходных продуктов горения (топливо, воздух) должна быть равна массе получающихся продуктов сгорания. Результаты расчета представим в виде таблицы.
Таблица 5 - Материальный баланс горения топлива (на 100 м3 газа)
|
Статьи прихода массы, кг |
Статьи расхода массы, кг |
|
Масса топлива mт = ρт·Lт = 1,266·100=126,6 |
Масса продуктов сгорания mпс = ρпс·Vд=0,95·325,6=309,3 |
|
Масса сухого
воздуха mв = ρв· |
|
|
Масса влаги воздуха
|
|
|
Приход массы mприх
= mт + mв
+ |
Расход массы mрасх = mпс=309,3 |
Невязка баланса рассчитывается по формуле
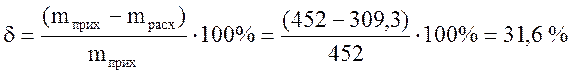 .
.
Действительная температура горения топлива находится по формуле
![]() , (7)
, (7)
где Tк - калориметрическая температура горения топлива, oC.
Определение калориметрической температуры горения топлива производится аналитическим методом последовательных приближений и интерполяции, для этого необходимо рассчитать энтальпию продуктов сгорания, соответствующую калориметрической температуре, по формуле:
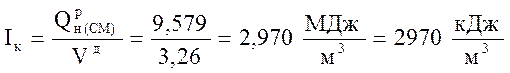 .
.
Задаёмся предполагаемой температурой горения T1=1700 oC и определяем энтальпию продуктов сгорания, соответствующую этой температуре, по формуле:
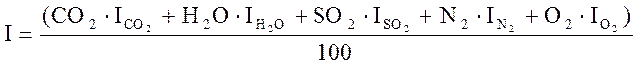 , (8)
, (8)
где ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() - энтальпии составляющих продуктов
сгорания, соответствующие предполагаемой температуре, кДж/м3.
- энтальпии составляющих продуктов
сгорания, соответствующие предполагаемой температуре, кДж/м3.
Значения энтальпий газов приведены в [2, таблица 8].
По формуле (8) определим энтальпию продуктов сгорания, соответствующую T1
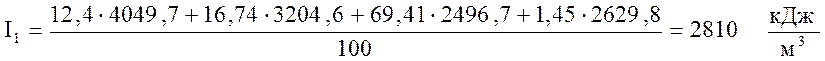 .
.
Т.к. I1<Iк , то задаёмся другим значением температуры T2=T1+100o=1800 oC и определяем по формуле (8) энтальпию продуктов сгорания, соответствующую T2
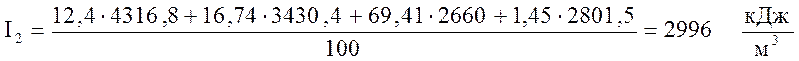 .
.
Т.к. I2>Iк , то находим искомую калориметрическую температуру на интервале 1700-1800 oC по формуле:
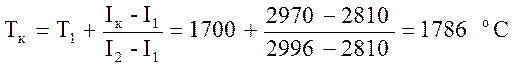 .
.
По формуле (7) находим действительную температуру горения топлива
![]() .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.