Например, найдем теплоемкость кислорода при температуре 170![]() . Так как значения
температуры 170
. Так как значения
температуры 170![]() в таблице нет, то
выпишем ближайшие значения:
в таблице нет, то
выпишем ближайшие значения:
100![]()
![]()
![]() = 0,9232
= 0,9232 ![]()
0
200![]()
![]()
![]() = 0,9353
= 0,9353 ![]()
0
Теперь проинтерполируем между этими значениями:
170![]() 100
100![]()
![]()
![]()
![]() =
= ![]() +
+ ![]()
![]() 70 = 0,9232 +
70 = 0,9232 + ![]()
![]() 70 = 0,9317
70 = 0,9317 ![]()
0 0
Среднюю массовую изохорную теплоемкость можно найти по формулам термодинамических процессов:
Адиабатный;
![]() = const, S=const, dq=0:
= const, S=const, dq=0:![]() Из уравнения
Майера:
Из уравнения
Майера: ![]() =
=![]() –
– ![]()
Изохорный;
![]() =const: Из уравнения
Майера:
=const: Из уравнения
Майера: ![]() =
=![]() –
– ![]()
Изотермический;
T=const: ![]()
Изобарный;
P=const: ![]() =
=![]() –
– ![]()
Политропный;
![]() =const:
=const: ![]() =
=![]() –
– ![]()
3. Изменения внутренней энергии ΔU и энтальпии Δi для каждого процесса цикла рассчитываются по формулам:
Δ![]() =
= ![]() (
( ![]() –
– ![]() ) ; Δ
) ; Δ![]() =
= ![]() (
( ![]() –
– ![]() )
)
Изменение энтропии ΔS для каждого процесса цикла можно найти из следующих формул:
Для
адиабатного: Δ![]() = 0
= 0![]()
Для
изохорного: Δ![]() =
= ![]() ln
ln ![]() =
= ![]() ln
ln ![]()
Для
изотермического Δ![]() =
= ![]() ln
ln ![]() =
= ![]() ln
ln ![]()
Для
изобарного: Δ![]() =
= ![]() ln
ln ![]() =
= ![]()
Для
политропного: Δ![]() =
= ![]() ln
ln ![]() =
= ![]()
Т.к. U, i и S являются функциями состояния, то за весь цикл:
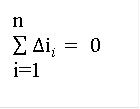 |
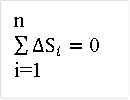 n
n
![]() ;
i=1
;
i=1
4. Теплота и работа в каждом процессе определяются по следующим формулам:
Адиабатный:
![]() = 0;
= 0; ![]() = - Δ
= - Δ![]()
Изохорный:
![]() = Δ
= Δ![]() =
=![]() (
( ![]() –
– ![]() ) ;
) ; ![]() = 0
= 0![]()
Изотермический:
![]() =
= ![]() =
= ![]() T ln
T ln ![]() =
=![]() T ln
T ln ![]()
Изобарный:
![]() =
= ![]() =
= ![]() (
( ![]() –
– ![]() ) ;
) ; ![]() = P (
= P (![]() -
- ![]() )
)
Политропный:
![]() =
= ![]() (
( ![]() –
– ![]() ) , где
) , где ![]() =
= ![]() ;
;
![]() =
= ![]() (
(![]() )
)![]() =
= ![]() (
(![]() –
– ![]() )
)
Таблица 1.2. Результаты расчета газового цикла
|
Процессы |
n |
|
|
Δ
|
Δ
|
Δ
|
q,
|
l,
|
|
|
|
|||||||||
|
a-b |
|||||||||
|
b-c |
|||||||||
|
c-d |
|||||||||
|
d-a |
|||||||||
|
|
|||||||||
5.
Определим подведенную ( в процессе расширения рабочего тела) теплоту ![]() и отведенную ( в
процессе сжатия) теплоту
и отведенную ( в
процессе сжатия) теплоту![]() и суммарную
работу за цикл с учетом правила знаков для работы ( работа расширения
положительна, сжатия – отрицательна).
и суммарную
работу за цикл с учетом правила знаков для работы ( работа расширения
положительна, сжатия – отрицательна).
![]() =
= ![]()
![]() =
=![]() –
– ![]() |
|
![]() =
=![]()
![]()
![]() =
=![]()
![]()
Согласно
первому закону термодинамики для цикла: ![]() =
= ![]()
6. Термический к.п.д. цикла:
![]() =
= ![]()
![]() =
= ![]()
7.
Изобразим на ТS - диаграмме, в масштабе, газовый цикл. Первая точка строится полу
произвольно, по оси ординат откладываем температуру ![]() , а по оси
абсцисс точку откладываем произвольно. Дальнейшие точки строятся строго в
соответствии со значениями температур и ΔS для каждого процесса.
, а по оси
абсцисс точку откладываем произвольно. Дальнейшие точки строятся строго в
соответствии со значениями температур и ΔS для каждого процесса.
II. ТЕРМОДИНАМИЧЕСКИЙ РАСЧЕТ ПАРОВОДЯНОГО ЦИКЛА
1.
Определяем с помощью iS – диаграммы и таблиц воды и водяного
пара термические p, ![]() , T и калорические
i, U, S параметры в
характерных точках цикла и заносим их в таблицу 3.
, T и калорические
i, U, S параметры в
характерных точках цикла и заносим их в таблицу 3.
Таблица 3. Параметры пароводяного цикла
|
Точка/Параметры |
P, бар |
V, |
t, |
|
|
|
X |
|
1 |
|||||||
|
2 |
|||||||
|
3 |
|||||||
|
4 |
|||||||
|
5 |
|||||||
|
6 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.