Реакция (1) получается суммированием реакций (2) - (4):
SiО2 = Si + О2 ΔН = - ΔН![]()
+ Si + C =
SiC ΔН = ΔН![]()
SiО2 + 3С = SiC + 2СО ΔН1 = - ΔН![]() + ΔН
+ ΔН![]() + 2ΔН
+ 2ΔН![]()
Естественно, что для реакций, написанных в обратную сторону, берется значение ΔН0 с противоположным знаком.
Рассматриваемая реакция (1) протекает при температурах более 1300 К. При температуре 2600 К, например, значения для составляющих реакций (2) - (4) будут соответственно равны: +875000, -104900, -124100 Дж/моль образующегося вещества, а для суммарной реакции (1)
ΔН1 = - ΔН![]() + ΔН
+ ΔН![]() + 2ΔН
+ 2ΔН![]() = 875000 - 104900 - 248200 =
= 875000 - 104900 - 248200 =
= 525000 Дж/моль SiO2(SiC), т.е. реакция эндотермическая и должна быть занесена в статьи расхода тепла.
Если в справочной литературе искомые величины приведены во внесистемных единицах (кал, атм и др.) необходимо привести их к системе СИ. Коэффициенты пересчета основных физико-химических величин приведены в приложении В.
С точки зрения II закона термодинамики можно допустить, что все реакции протекают при одной температуре, которая может быть принята за начало отсчета, например, температуре окружающей среды, которая в большинстве случаев принимается равной 25 °С. Тогда все значения ΔН0 выбираются при температуре 298 К. В этом случае в расходных статьях теплового баланса необходимо учитывать тепло на нагрев продуктов реакции от 298 К до температуры, при которой продукты удаляются из реактора, с учетом эффектов всех дополнительных превращений (фазовых, химических), совершающихся как с продуктами реакций, так и с исходными веществами (например, дегидратация, полиморфные превращения в исходном сырье, диссоциация сложных соединений на более простые и т.п.).
Значения ΔН![]() образования химических соединений,
наиболее часто используемых в практике электротермических производств,
приведены в приложении Г (таблица Г.1).
образования химических соединений,
наиболее часто используемых в практике электротермических производств,
приведены в приложении Г (таблица Г.1).
В случае, когда рассматривается большое количество реакций, более целесообразным следует считать другой метод расчета, по которому тепловые эффекты всех элементарных эндотермических реакций, для которых в справочниках указаны положительные значения ΔН0, заносятся в статьи расхода, а тепловые эффекты экзотермических реакций - в статьи прихода теплового баланса. Это упрощает расчеты в том отношении, что для расчетов можно пользоваться непосредственно табличными данными, не находя в соответствии с законом Гесса значения ΔН для суммарных реакций. Очевидно, что применительно к реакции (1) в статьи прихода тепла следует включить тепловые эффекты реакций карбидообразования (3) и горения углерода (4); эндотермическая реакция диссоциации кремнезема должна быть отнесена к расходным статьям теплового баланса.
Тепловые эффекты реакций рассчитываются на 1 моль (г·ат ) одного из реагирующих веществ и пересчитываются на количество этого вещества, полученное в материальном балансе.
3.6.2.1.2 Теплота образования растворов - Qp. Эта статья имеет место для случаев, когда в процессе взаимодействия шихтовых материалов образуются сложные металлические и шлаковые растворы, при этом необходимо учесть тепловой эффект смешения компонентов; этот эффект можно характеризовать интегрально молярной энтальпией смешения.
Пример. В соответствии с материальным балансом в процессе образовалось 120 г сплава состава: 10 % [Si] и 90 % [Fe] (по массе).
![]() , где
xi - мольная доля i-го компонента (i - Si);
, где
xi - мольная доля i-го компонента (i - Si);
Аi(Мi) - атомная (молекулярная) масса i-гo компонента.
Аналогично находится xFe = 0.818.
Н![]() =10900 Дж/гּат Si (см. рисунок 1,точка В) и [5].
=10900 Дж/гּат Si (см. рисунок 1,точка В) и [5].
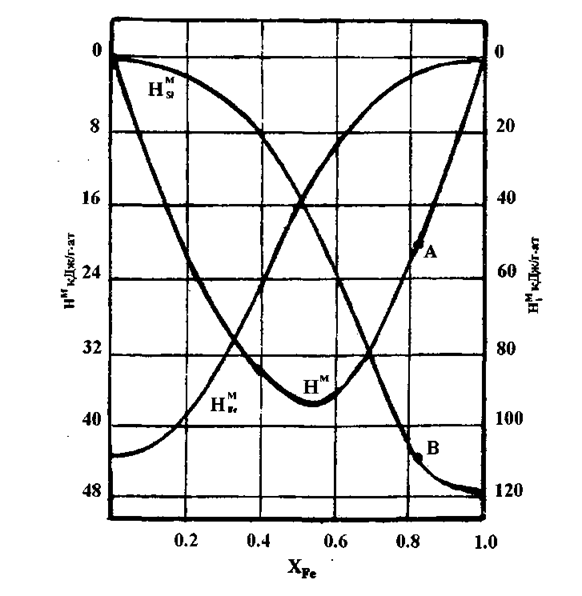
Рисунок 1 – Энтальпии смешения жидкого железа и жидкого кремния
при 1873 К
В 100 г сплава содержится кремния
![]() молей.
молей.
Тепловой эффект смешения на 120 г сплава состоит
Qp = 109000ּ0.429 = 47000 Дж.
Эту же величину можно найти, определив теплоту смешения на 1гׁат сплава (рисунок 1, точка А):
Н![]() = 20000 Дж/гׁат сплава.
= 20000 Дж/гׁат сплава.
Количество грамм атомов сплава
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.