1. Химические превращения протекают совершенно раздельно в различных интервалах температур. В этих случаях между отдельными стадиями разложения, образующими четко определенные волны, просто и точно могут быть определены разницы веса (рисунок 6).
2. Химические реакции в большинстве случаев в большей или меньшей степени перекрывают друг друга.
По кривой ТГ в этом случае трудно установить, какая часть замеченного изменения веса относится к одной реакции и какая ко второй из следующих друг за другом реакций. Совместная оценка кривых ТГ и ДТГ помогают решить эту задачу. На кривой ДТГ минимумом отмечается точка, где одна реакция практически закончена и начинается вторая, поэтому, проектируя такие точки на кривую ТГ, можно установить величины изменения веса, относящиеся к отдельным реакциям. Например, на кривой ТГ боксита при температуре 565 0С никакая точка перелома не обнаруживается. Следовательно, если бы определялась лишь кривая ТГ, не было бы возможности установить, что в боксите наряду с каолинитом содержится и другое вещество (бемит). Но с помощью кривой ДТГ удалось вычислить с относительной точностью количество боксита и каолинита, проектируя минимум кривой ДТГ на кривую ТГ (рисунок 7).
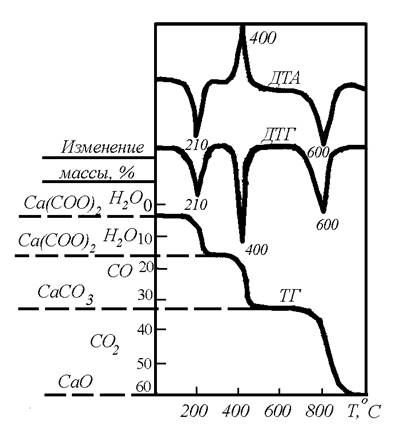
Рисунок 6 – Термическое разложение Ca (COO)2 ×H2O
Путем сопоставления кривых ДТА и ДТГ можно производить оценку происходивших в пробе термических реакций одновременно с двух сторон, с точки зрения изменения энтальпии и изменения веса.
При сопоставлении кривых ДТА и ДТГ можно выделить три случая. Первый из них – кривая ДТА. Это означает, что в пробе произошло какое-то физическое превращение (изменение фазового состояния, перекристаллизация) или химическая реакция, не сопровождающаяся изменением веса (обменные процессы). Характерным примером этого случая служит экзотермический максимум кривой ДТА нежского боксита при температуре 950 0С (рисунок 7), означающий кристаллизацию мета-каолинита, происходящего от разложения каолинита.
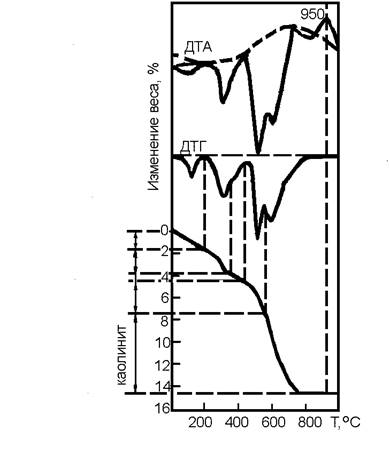
Рисунок 7 – Дериватограмма нежского боксита
Второй случай наблюдается, если в пробе при данной температуре происходит химическая реакция, не сопровождаемая какими-либо иными химическими или физическими превращениями. Характер поведения кривых ДТА и ДТГ одинаков. Например, на дериватограмме «Сецкого» боксита видно, что максимумы кривых ДТА и ДТГ совпадают, за исключением экзотермического максимума при температуре 920 0С, связанного с разложением каолинита (рисунок 8).
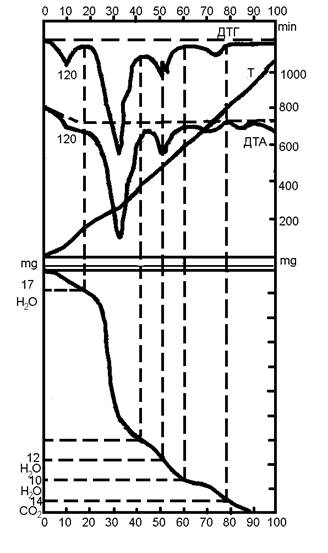
Рисунок 8 – Термическое разложение «Сетского» боксита
Третий случай более сложен. Обе кривые показывают изменение в образце, но их формы, различны. Такое обстоятельство указывает на то, что данный участок кривой ДТА был получен в результате сложения термических эффектов двух или нескольких превращений.
Примером этого случая может быть разложение кислого фталевокислого калия в атмосфере азота (рисунок 9).
Было установлено, что это превращение происходит в трёх ступенях. Сначала в интервале температур от 190 до 380 0С происходит первое превращение кислого фталевокислого калия в дикалевую соль фталевой кислоты, и этот процесс однозначно является эндотермическим процессом. При температуре около 500 0С разложился и фталевокислый калий (вторая ступень, эндотермический процесс). Конечным продуктом термического разложения исходного вещества (третья ступень) является углекислый калий. Максимум кривой ДТА при температуре 440 0С означает разложение кислого фталевокислого калия, а максимум при 890 0С - расплавление углекислого калия. Вместе с тем, установлено, что имело место и превращение экзотермического характера (образование сильно полимеризированных смолистых продуктов) в области температур 600 0С.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.