







МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ НЕФТИ И ГАЗА им. И.М. ГУБКИНА
КАФЕДРА ОРГАНИЧЕСКОЙ ХИМИИ И ХИМИИ НЕФТИ
КУРСОВАЯ РАБОТА
по синтетическим методам органической химии
на тему:
«Этиловый эфир бензойной кислоты»
Выполнил: студент группы ХТ-06-3
Проверил: преподаватель
МОСКВА 2008 г.
Содержание
1. Введение. 3
2.Теоретическая часть. 3
2.1. Формула соединения и его названия. 3
2.2. Физические свойства соединения. 3
2.3. Химические свойства соединения. 4
2.4. Применение соединения. 6
2.5. Методы получения этилбензоата. 6
2.6. Основание выбора схемы синтеза соединения. 7
3. Экспериментальная часть. 8
3.1. Расчет количеств исходных веществ по второй стадии. 8
3.1.1. Уравнение основной и побочной реакции. 8
3.1.2. Расчет и таблица характеристик и количеств исходных реагентов и продуктов реакции. 8
3.1.3. Описание синтеза [2] 9
3.1.4 Константы полученного соединения. 10
3.2. Расчет количеств исходных веществ по первой стадии. 10
3.2.1. Уравнение основной и побочной реакции. 10
3.2.2. Расчет и таблица характеристик и количеств исходных реагентов и продуктов реакции. 10
3.2.3. Описание синтеза [2] 11
3.2.5. Схема установки. 13
4. Вывод. 14
5. Используемая литература. 15
По окончанию лабораторного практикума по органической химии проводится литературный анализ. Целью литературного анализа является нахождение литературы по данному веществу, проведение синтеза вещества и анализ полученных результатов.
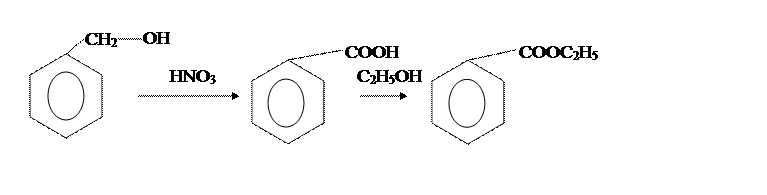
Целью нашего синтеза является получение этилового эфира бензойной кислоты (6 г). Синтез проводится в две стадии (получение бензойной кислоты – первая стадия, получение этилового эфира бензойной кислоты – вторая стадия).
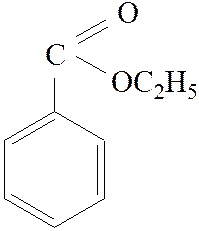
Этиловый эфир бензойной кислоты (этилбензоат)
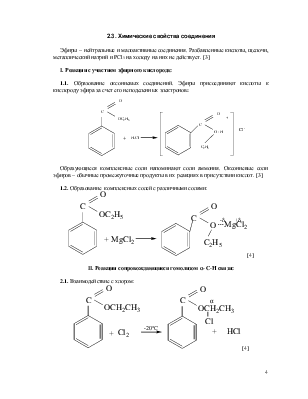
Эфиры – нейтральные и малоактивные соединения. Разбавленные кислоты, щелочи, металлический натрий и PCl5 на холоду на них не действует. [3]
I. Реакции с участием эфирного кислорода:
1.1. Образование оксониевых соединений. Эфиры присоединяют кислоты к кислороду эфира за счет его неподеленных электронов:
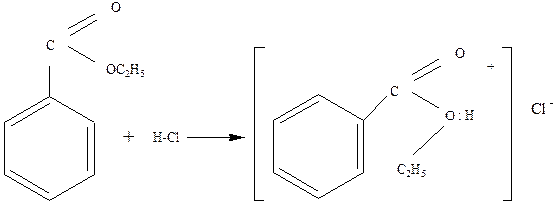
Образующиеся комплексные соли напоминают соли аммония. Оксониевые соли эфиров – обычные промежуточные продукты в их реакциях в присутствии кислот. [3]
1.2. Образование комплексных солей с различными солями:
![]()
![]()
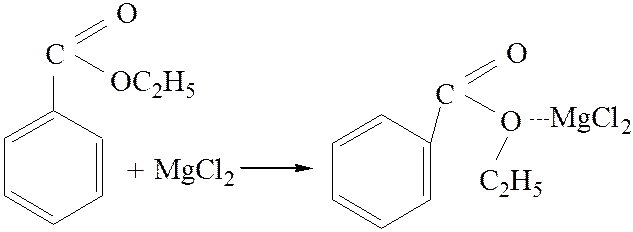 [4]
[4]
II. Реакции сопровождающиеся гомолизом α- С-Н связи:
2.1. Взаимодействие с хлором:
![]()
![]()
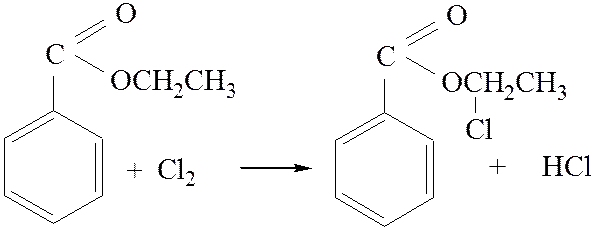 [4]
[4]
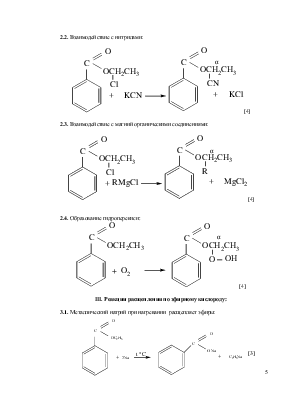
2.2. Взаимодействие с нитрилами:
![]()
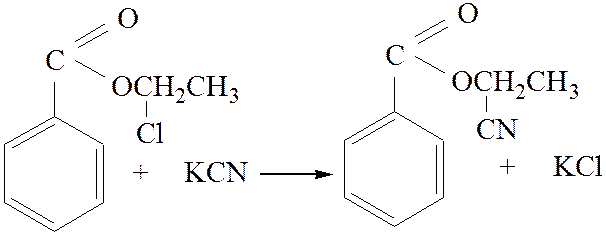 [4]
[4]
2.3. Взаимодействие с магний органическими соединениями:
![]()
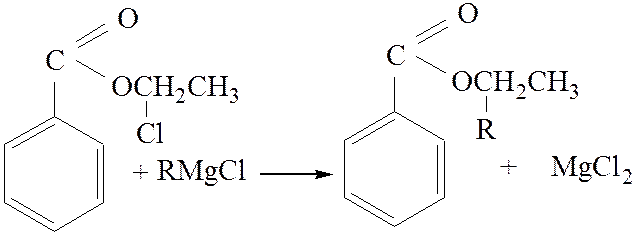 [4]
[4]
2.4. Образование гидроперекиси:
![]()
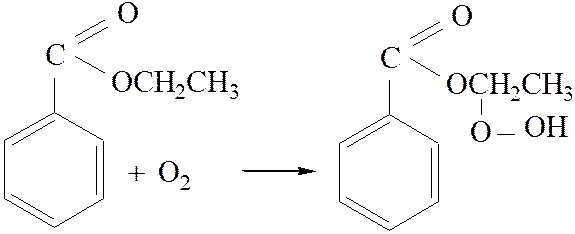 [4]
[4]
III. Реакции расщепления по эфирному кислороду:
3.1. Металлический натрий при нагревании расщепляет эфиры:
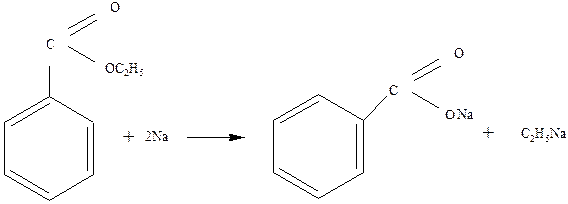
![]()
[3]
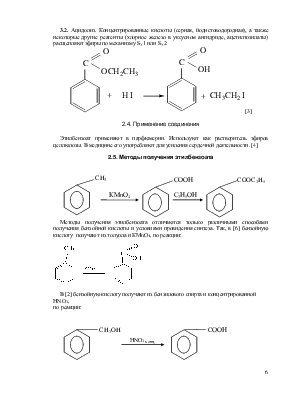
3.2. Ацидолиз. Концентрированные кислоты (серная, йодистоводородная), а также некоторые другие реагенты (хлорное железо в уксусном ангидриде, ацетилтозилаты) расщепляют эфиры по механизму SN1 или SN2:
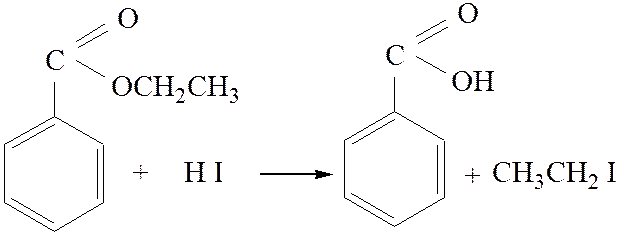 [3]
[3]
Этилбензоат применяют в парфюмерии. Используют как растворитель эфиров целлюлозы. В медицине его употребляют для усиления сердечной деятельности. [4]
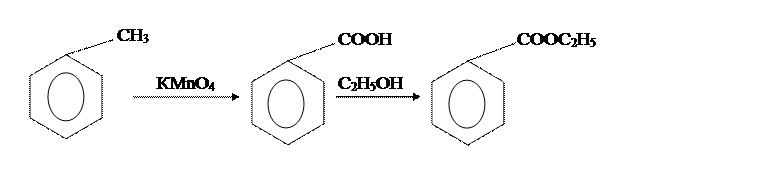
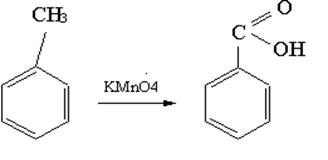
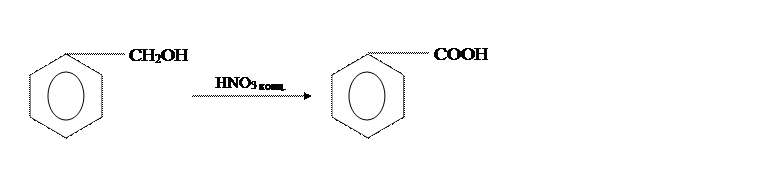
В [2] бензойную кислоту получают из бензилового спирта и концентрированной НNO3,
|
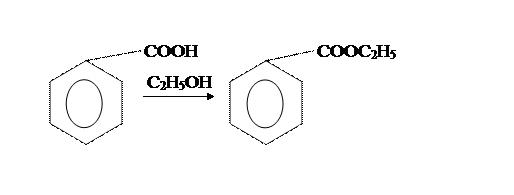
Вторая стадия отличается только способами провидения аппаративного оформления этерификации бензойной кислоты этиловым спиртом.
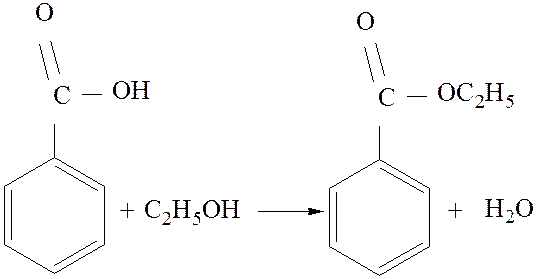 |
Из приведенных методик наиболее оптимальна вторая. [2]
1) С учетом ограниченности времени, эта методика меньше времени занимает при ее проведении.
2) В лаборатории имеются все необходимые реактивы и приборы для проведения данной методики.
3.1.1. Уравнение основной и побочной реакции.
Уравнение основной реакции
Уравнение побочной реакции
2C2H5ОН ↔ C2H5ОC2H5 + H2O
А. Расчет по уравнению реакции (для получения 6 г этилбензоата):
6 г этилбензоата соответствует количество вещества:
![]()
1) По уравнению: υ(C6H5-COOC2H5) : υ(C6H5-COOH) = 1 : 1
По условию: υ(C6H5-COOC2H5) : υ(C6H5-COOH) = ![]() : X
: X
ð υ(C6H5-COOH) = 0,04 моль;
m(C6H5-COOH) = ![]()
2) По уравнению: υ(C6H5-COOC2H5) : υ(C2H5-OH) = 1 : 1
По условию: υ(C6H5-COOC2H5) : υ(C2H5-OH) = ![]() : X
: X
ð υ(C2H5-OH) = 0, 04 моль;
m(C2H5-OH) = ![]() = 1,84
г
= 1,84
г
Б. Расчет количеств веществ по практикуму:
В практикуме Агрономова для получения 10 г этилбензоата используется 10 г бензойной кислоты, 26 г (33мл) этилового спирта, 1 мл H2SO4 (d=1,84):
Для синтеза 6 г этилбензоата требуется бензойной кислоты:
10 г ~ 10 г
=> х = 6 г
6 г ~ х г
Для синтеза 6 г этилбензоата требуется этилового спирта:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.