Разветвленные
цепные р-ции(ц.р.) могут переходить во взрывной режим при определ-ных
давлениях,тем-ре,составе реакцион. смеси и др. переменных. Экспер-но, на
примере окис-я сероводорода кислородом,было
установлено,что смесь
может 3 раза переходить во взрывной режим,т.е. в смеси можно создать 3 значения давлений
и тем-ры,при к-рых она взрывается.Эти дав-я и тем-ры наз-ют 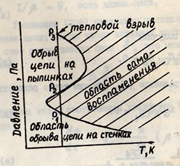 пределами
самовоспламенения смеси(см.рис.)При дав-ях ниже Р1 смесь H2S и O2 не взрыв-ся,т.к. она значит-но
разбавлена и среднее число актов обрыва цепей на стенках сосуда, в к-ром нах-ся
смесь, превышает число разветвлений цепей.При Р1 смесь взрыв-ся,т.к.
в этом случае число обрывов цепи уже ниже числа развития цепей.При дав-ях выше
Р2 смесь не взрыв-ся,т.к. обрыв цепи происходит при столковении
актив.частиц в объёме реакцион.смеси на пылинках(или др. массив.частицах).При
дав-ях,равных Р2, смесь взрыв-ся,т.к. число разветвлений цепей выше
числа их обрывов на третьих частицах.3-ий предел взрыв-ти происходит при Р3
и обусловлен тепловой природой процессов,особ-но легко он проходит для
экзотермич.р-ций.При сжатии смесей происходит их сильный разогрев,к-рый
приводит к их взрыву.Тепловому взрыву способ-ют каталит.действи стенок
сосуда,на к-рых при адсорбции могут создаваться актив.частицы.Особ-ть ц.р.- наличие
периода индукции в превращении исх.смеси в-в.За время периода идукции в смеси
накаплив-ся а.ч.,к-рые приводят к постепенному развитию ц.р. с послед. взрывом.
пределами
самовоспламенения смеси(см.рис.)При дав-ях ниже Р1 смесь H2S и O2 не взрыв-ся,т.к. она значит-но
разбавлена и среднее число актов обрыва цепей на стенках сосуда, в к-ром нах-ся
смесь, превышает число разветвлений цепей.При Р1 смесь взрыв-ся,т.к.
в этом случае число обрывов цепи уже ниже числа развития цепей.При дав-ях выше
Р2 смесь не взрыв-ся,т.к. обрыв цепи происходит при столковении
актив.частиц в объёме реакцион.смеси на пылинках(или др. массив.частицах).При
дав-ях,равных Р2, смесь взрыв-ся,т.к. число разветвлений цепей выше
числа их обрывов на третьих частицах.3-ий предел взрыв-ти происходит при Р3
и обусловлен тепловой природой процессов,особ-но легко он проходит для
экзотермич.р-ций.При сжатии смесей происходит их сильный разогрев,к-рый
приводит к их взрыву.Тепловому взрыву способ-ют каталит.действи стенок
сосуда,на к-рых при адсорбции могут создаваться актив.частицы.Особ-ть ц.р.- наличие
периода индукции в превращении исх.смеси в-в.За время периода идукции в смеси
накаплив-ся а.ч.,к-рые приводят к постепенному развитию ц.р. с послед. взрывом.
![]() . P1,P2,Р-предел.дав-я взрыва и
общ.внеш.дав.Т0-постоянная.При Р< P1 и P> P2 T0<0→затух-щий пр-с,при P1<Р< P2 T0>0→пр-с протекает с
самоускорением.Т-хар-ет вр,в теч к-рого конц-я промеж. продуктов увел-ся в е
раз. Вр,в теч. к-рого скорость пр-ся переходит от незначительной неизмер.вел. к
оч.большой измер.величине.
. P1,P2,Р-предел.дав-я взрыва и
общ.внеш.дав.Т0-постоянная.При Р< P1 и P> P2 T0<0→затух-щий пр-с,при P1<Р< P2 T0>0→пр-с протекает с
самоускорением.Т-хар-ет вр,в теч к-рого конц-я промеж. продуктов увел-ся в е
раз. Вр,в теч. к-рого скорость пр-ся переходит от незначительной неизмер.вел. к
оч.большой измер.величине.
53. Теория теплового взрыва.
Кратко рассмотрим анализ теплового режима в случае сильно экзотермической реакции.
В стационарном состоянии соблюдается тепловой баланс реакционной зоны, поскольку тепловыделение за счет реакции и отвод тепла сбалансированы Q+=Q-. Для реакции 1го порядка можно записать
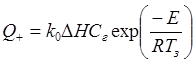 (4.10)
(4.10)
![]() (4.11)
(4.11)
где Cг – концентрация реагента в газовой фазе, at –коэффициент теплоотдачи, индексы ‘з’ и ‘о’ относятся к реакционной зоне и окружающей среде. Ясно, что при низких температурах, когда наклон прямых теплоотдачи, т.е. at, больше, чем производная dQ+/dT, реализуется стационарное состояние и т.д., вплоть до некой критической температуры T*, в которой at=dQ+/dT, т.е. линия теплоотдачи становится касательной к кривой тепловыделения:
![]() (4.12)
(4.12)
Кроме того, в точке Т = T* еще выполняется условие теплового баланса, т.е. Q+ = Q- Поскольку эта точка является переходной между кинетической и диффузионной областями, имеется также заметный градиент концентрации, и для скорости реакции справедливо выражение
![]() ,
(4.13)
,
(4.13)
где km- коэффициент массопередачи. Используя известные из макрокинетики и теории подобия корреляции междуat и km, в том числе числа Рейнольдса, Шмидта и Прандтля, найдем
km/at = 0,7/(cp r), (4.14)
где cp и r означают молярную теплоемкость и плотность газообразной смеси. Окончательное выражение для критической температуры T* имеет вид
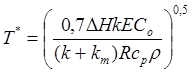 .
(4.15)
.
(4.15)
Следует подчеркнуть, что при температуре ≥T* стационарный режим в кинетической области уже невозможен, и система скачком (за время меньше 1 мин) переходит в диффузионную область, которая характеризуется весьма большим градиентом температуры DT= Tр –Tо. Этот самопроизвольный разогрев в реакционной зоне можно рассчитать в адиабатическом приближении, считая, что все тепло реакции идет на нагрев реакционной смеси.
![]() (4.16)
(4.16)
33. Диффузионный скачок потенциала.
Для двух растворов с одинаковым растворителем, но разной концентраций, скачок потенциала на границе раздела бвух растворов наз-ся диффузионным. Скорости диффузии катионов и анионов различны. Раствор 2 получит избыток положительных, а 1- избыток отрицательных. С течением времени скорости становятся одинаковыми, в стационарном состоянии электролит диффундирует как единое целое. При этом каждый раствор имеет заряд, и разность поетнциалов между ними соответсвует диффузионному.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.