I. Реагирующий газ адсорбируется
слабо, продукт реакции — умеренно. Из этих исходных условий вытекает, что КА
рА ‹‹1, этой величиной можно пренебречь, т. е. ![]() →
→ ![]()
где k* = кКА— кажущаяся константа скорости реакции.
Примером реакции, кинетика которой подчиняется этому уравнению является реакция распада закиси азота N2O на платине. Процесс распада тормозится кислородом.
2. Реагирующее вещество адсорбируется слабо,
продукт реакции — сильно. В этом случае, согласно сказанному выше, КА
рА ‹‹1 , а КВРВ ›› 1→ ![]() и, следовательно,
и, следовательно,
![]() ,где k* = k(kA/kB).
,где k* = k(kA/kB).
Примером такого процесса может служить
разложение аммиака на платине. 3. Реагирующее вещество и продукт реакции адсорбируется
сильно. Тогда КА рА
››1 , а КВРВ ›› 1 и, следовательно: ![]() →
→![]() ,
где k* = kКA
,
где k* = kКA
Примером такой реакции является реакция дегидратаций этилового спирта на окиси алюминия.
Если два реагирующих вещества адсорбируются
па одинаковых адсорбционных центрах и истинный порядок реакции — второй, то общее
уравнение кинетики можно записать следующим образом: ![]()
Реакторы проточного типа могут применяться двух типов: пустотелые или имеющие распределительные решетки. Процессы в таких реакторах проходят в потоке, в реакторе идеального вытеснения реакционной смеси с неподвижным слоем катализатора или в потоке. В этом случае через слой неподвижного шарикового или движущегося с малой скоростью катализатора сырье проходит в поршневом режима, то есть, когда предыдущий слой сырья вытесняет передний его фронт.
Скорость гетерогенной каталитической для режима идеального вытеснения
Гидродинамический РИВ реакционной смеси может соблюдаться для реактора, в котором отношение длины его к диаметру больше пятидесяти (l / d > 50). Уравнения скорости реакций, протекающей в потоке, можно получит на основе анализа уравнения потока массы веществ.
Гомогенный поток массы веществ в нестационарных условиях, находящийся под воздействием конвективной силы к в котором проходит химическая реакция:
![]() (1),где
(1),где ![]() - объемно-молекулярная
концентрация, NA, VA-мольная и объемная скорости подача веществ,V - линейная скорость перемещения
потока веществ,
- объемно-молекулярная
концентрация, NA, VA-мольная и объемная скорости подача веществ,V - линейная скорость перемещения
потока веществ,
w - скорость химической реакции в гомогенной системе, τ-время.
Для перехода к уравнению потока массы веществ через слой зернистого катализатора необходимо учитывать тот факт, что вещество перемещается только между зернами катализатора.
Вводим коэффициент ![]() , определяющий долю площади реактора,
свободной от катализатора.
, определяющий долю площади реактора,
свободной от катализатора.
S0V-площадь единицы объема катализатора. Умножим
уравнение (1) на ![]() /S0V
/S0V
![]()
Введем обозначение![]()
Запашем концентрацию и лилейную скорость через соотношения:
![]() ; V=Va/Ps*χ. Ps-площадь раствора в сечении Получим:
; V=Va/Ps*χ. Ps-площадь раствора в сечении Получим: 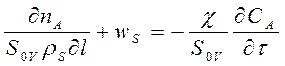
Для стащюиарных условий (для равномерной подачи
сырья в реактор) концентрация вещества А не
меняется со временем по длине реактора И тогда первая производная по времени
будет равна нулю ![]()
Уравнение потока массы веществ для стационарных
условий: 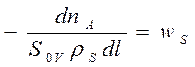
Уравнение
скорости химической реакции, протекающей в потоке, в гетерогенной, системе, для
РИВ. Если количество непрореагировавшего вещества А обозначить как ![]() , тогда
, тогда ![]() n0а –мольн.скорость подачи А.
n0а –мольн.скорость подачи А.
х-превращение, моль/моль. Это ураанв&ао скорости было выведено впервые АД,Баландиным и повторено с теоретическим выводом Г.М.Дакчевкоаым,
Скорость
гетерогенной каталитической реакции зависит от количества сорбированного
катализатором вещества, от давления, темперы, природы катализатора,
наличия в реакционной смеси астехиометрических компонентов и других факторов.
Скорость гетерогенной каталитической реакции будет прямо пропорциональна
поверхностной концентрации реагирующих веществ, возведенных в степень
соответствующих порядку реакции. Для ![]() Уравнение
кинетики.:
Уравнение
кинетики.: 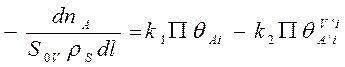
П-знак произведения., θ-относительные поверхностные концентрации веществ.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.