2. Взаимодействие между ионом и нейтральной молекулой
Согласно уравнению γ= ![]() , коэффициент активности для
нейтральной молекулы γ=
, коэффициент активности для
нейтральной молекулы γ= ![]() и для реакции A+Bzb→AB*(Zb) → продукты получаем
и для реакции A+Bzb→AB*(Zb) → продукты получаем ![]()
Следовательно, константа скорости должна быть прямо пропорциональна ионной силе. Зависимость константы скорости реакции от ионной силы называют первичным солевым эффектом. Вторичный солевой эффект (в случае слабых электролитов) – скорость реакции изменяется вследствие изменения одного из реагирующих присутствующих посторонних электронов, изменяющих ионную силу раствора и соответственно степень диссоциации реагирующего электролита.
72. Влияние природы растворителя и давления на скорость химической реакции, проводимой в растворе.
При рассмотрении процессов в растворах необходимо учитывать структуру и природу растворителя и растворенного вещества, структуру, химический состав раствора и условия протекания реакции.
Растворители бывают полярные или неполярные Растворы: ионные и молекулярные, концентрированные и разбавленные, идеальные и неидеальные. Структура чистых жидкостей – пространственные группы молекул (тетраэдр, тригональная бипирамидальная, октаэдр и др). Из сочетания 2-х, 3-х и более полиэдров создается ансамбль полиэдров. Число молекул растворителя, окружают такую же молекулу или ион – координационное число. При растворении в растворителе жидкости, газа или тв. вещества происходит их диспергирование до молекул или ионного состояния. Молекулы или ионы растворенного вещества занимают пустоты в полиэдрах или разрушая их, создают новые.
Реагирующее вещество вступает не в форме индивидуальных молекул, а в форме сольватов. Молекула движется в «клетке» из молекул растворителя, движение колебательное и, следовательно, число столкновений больше, чем в газе, т. к. молекулы плотно упакованы в жидкости. W= kcini, k зависит от природы растворителя. Мономолекулярные реакции в жидкостях и в газовой фазе происходят с одинаковыми скоростями.
Пусть в растворе протекает
реакция: A+B![]() A..B
A..B ![]() C , раствор
неидеальный.
C , раствор
неидеальный.
По ЗДМ 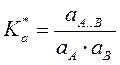 или
или
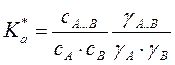 ,где a и y – активности и коэффициенты активности
,где a и y – активности и коэффициенты активности
Концентрация переходного
состояния: ![]() . По теории переходного состояния
. По теории переходного состояния ![]() , h-постоянная
Планка При
, h-постоянная
Планка При ![]() получим
получим ![]() Скорость
химической реакции зависит от природы растворителя. Так при y=10
скорость реакции в растворе в 10 раз выше чем в газовой фазе.При y=1 скорость реакции в растворе = скорости в газовой фазе.
Скорость
химической реакции зависит от природы растворителя. Так при y=10
скорость реакции в растворе в 10 раз выше чем в газовой фазе.При y=1 скорость реакции в растворе = скорости в газовой фазе.
Для мономолек.р-ции A ó A* ->
продукты 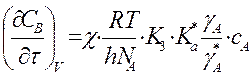 и при
и при ![]() получим:
получим:
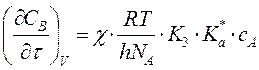 ,
т.е. скорость реакции не зависит от природы растворителя.
,
т.е. скорость реакции не зависит от природы растворителя.
Конст. равновесия 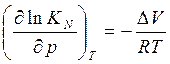 (V-изменяется
обратно в результате реакции)
(V-изменяется
обратно в результате реакции)
![]() тогда
тогда
![]()
По теории АК: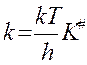 , логарифм. и дифф. по реакции:
, логарифм. и дифф. по реакции:
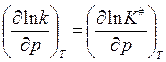 или
или
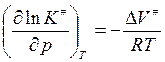 (Vизменяется
обратно активности)
(Vизменяется
обратно активности)
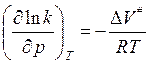 (если
ΔV<0- константа скорости увеличивается с ростом
давления)
(если
ΔV<0- константа скорости увеличивается с ростом
давления)
Получим: ![]() k(0)- константа скорости при нулевом давлении.
k(0)- константа скорости при нулевом давлении.
Продукты могут адсорбироваться на поверхности; катализатора и тем самым уменьшать поверхность, занятую реагирующим веществом. Это будет приводить к торможению процесса. Поэтому при расчете поверхности, занятой реагирующим веществом, следует учитывать адсорбцию продуктов распада.
Если адсорбируются два вещества А и В, то можно написать θ=Кр
![]()
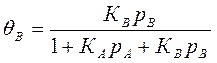 ,где КА и Кв; ра
и рВ — адсорбционные коэффициенты и парциальные давления веществ Аи
В. *
,где КА и Кв; ра
и рВ — адсорбционные коэффициенты и парциальные давления веществ Аи
В. *
Если реагирует только одно вещество и
реакция на поверхности следует уравнению первого порядка (истинный порядок), то
уравнение кинетики химического процесса запишется следующим образом: ![]()
Рассмотрим несколько примеров расчёта,, основанного на использовании уравнения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.