синее окрашивание
2. Сочетание солей диазония с фенолами или аминами с образованием азокрасителей:
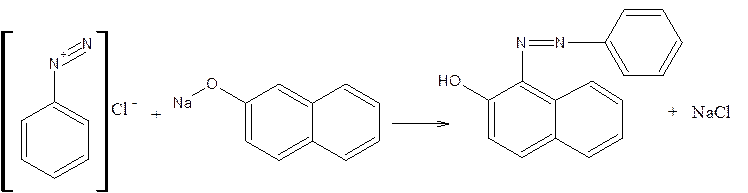
Вторичная аминогруппа
Образование нитрозосоединений
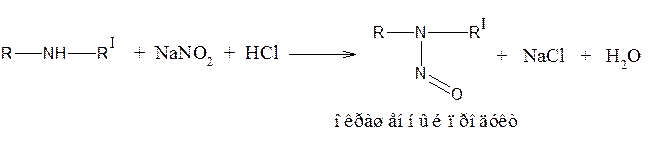
Третичный атом азота
1. Комплексообразование с общеосадительными реактивами

Х = FeCl3 , или KBiI4 (реактив Драгендорфа), или пикриновая кислота
2. Реакция нейтрализации (используется для количественного определения)
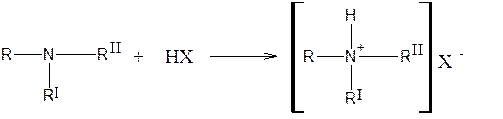
Нитрогруппа
1. Восстановление до – NH2 и реакции по первичной аминогруппе
[H]
![]() R – NO2 R – NH2
R – NO2 R – NH2
2. Образование ацисоли:
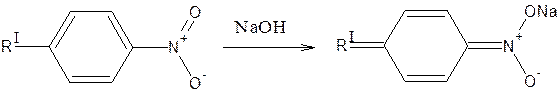
Лактамная группа
1. Гидролиз
![]()
![]()
![]()
![]()
![]()
![]() С О COOH
С О COOH
![]() + HOH
+ HOH
![]() NH NH2
NH NH2
2. Образование гидроксаматов металлов (см. выше).
Сульфгидрильная группа
![]() Определение меркаптидов при взаимодействии с
солями тяжелых металлов:
Определение меркаптидов при взаимодействии с
солями тяжелых металлов:
![]() R – SH + MeX R
– S – Me + HX
R – SH + MeX R
– S – Me + HX
окрашенное соединение
Для фармацевтического анализа используют реакции образования меркаптидов с солями тяжелых металлов, реакции окисления и щелочного гидролиза.
Сульфамидная группа замещенная
1. Реакция образования натриевой соли и комплексных солей с солями тяжелых металлов (CuSO4)
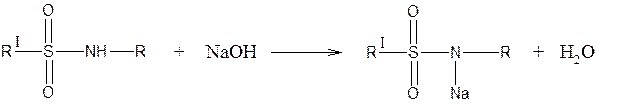
Реакция используется для количественного определения сульфаниламидных средств методом алкалиметрии.
Кратные (ненасыщенные) углерод-углеродные связи
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() С С галогенирование С С
С С галогенирование С С
Hal Hal
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() С С
окисление (KMnO4) С С
С С
окисление (KMnO4) С С
ОН ОН
Активная метиленовая группа
Реакция конденсации с альдегидами
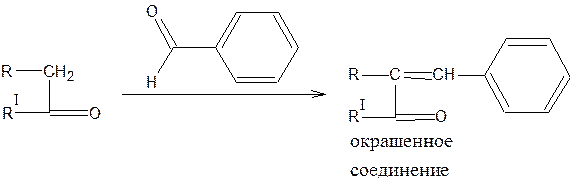
Галоген-углеродная функция
Наличие галогена устанавливают после его перевода из органически связанного состояния в ионогенное. Для этого применяют следующие методы:
1. Окисление а) жидкими окислителями: HNO3, дымящая H2SO4.
б) сплавление с сухими окислителями: Na2CO3 + CaO
в) газообразным кислородом
2. Восстановление а) гидрирование в присутствии Ni-катализатора б) восстановление водородом в момент выделения
(в токе водорода или газообразного NH3 галоген превращается в галогеноводород или соль аммония)
цинковой пылью в метод Степанова присутствие ледяной (восстановление металлическим
СН3СООН или Н2SO4 натрием в присутствии этанола)
Выбор реагента зависит не только от природы галогена, но и от прочности связи - С – Hal. Так, атом йода, имеющий большой атомный радиус, можно отщепить путем нагревания или воздействия концентрированной серной кислоты даже от ароматического кольца; тогда как атом хлора в этом случае может быть ионизирован только воздействием водорода в момент выделения или спекания с карбонатом натрия.
Атомы галогена (Cl, Br, I) в алифатической цепи могут быть ионизированы действием растворов щелочи или нитрата серебра. В то же время атомы фтора даже в случае алифатических фторпроизводных могут быть оторваны путем нагревания с металлическим натрием.
После минерализации до галогенидов или неорганических кислородных галогеносодержащих соединений используют обычные аналитические реакции и титриметрические методы.
В данной лекции рассмотрены реакции основных функциональных групп, встречающихся в структуре органических лекарственных веществ. Более подробно функциональный анализ будет изучен при характеристике конкретных лекарственных средств.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.