Почему энергия ионизации атома кислорода меньше чем азота ?
4) Рассчитайте третий потенциал ионизации атома лития
5) Какие степени окисления можно предсказать для атомов с валентной электронной конфигурацией 2s22p5
Выполнил:
.
гр. 5513
Преподаватель:
г. Санкт-Петербург
2009 г.
(1.1) Сформулируйте Принцип Паули и Правило Хунда .
Согласно расчетам, электрон движется не по какой-то определенной траектории, а может находиться в любой части околоядерного пространства - т.е. можно говорить лишь о вероятности (возможности) его нахождения на определенном расстоянии от ядра. Электроны в атоме занимают самые энергетически выгодные атомные орбитали (орбитали с минимальной энергией), образуя электронные облака определенной формы.
В случае S-орбитали электронное облако сферическое В случае P-орбитали облако гантелеобразная
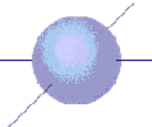
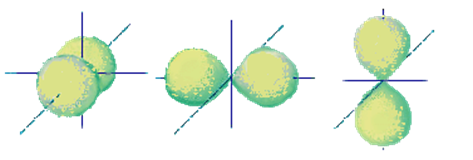 Внутри
атомных орбиталей вероятность нахождения электронов велика; иными словами,
имеется высокая электронная плотность. Пространство вне объема орбиталей
соответствует малой электронной плотности.
Внутри
атомных орбиталей вероятность нахождения электронов велика; иными словами,
имеется высокая электронная плотность. Пространство вне объема орбиталей
соответствует малой электронной плотности.
Принцип Паули:
“ На любой орбитали может находиться не более двух электронов, причем с противоположно направленными спинами (спин – особое свойство электрона, не имеющее аналогов в макромире, которое упрощенно можно представить как вращение электрона вокруг собственной оси).“
правило Хунда:
“ Вырожденные (с одинаковой энергией) орбитали заполняются одиночными электронами с одинаково направленными спинами, лишь после этого идет заполнение вырожденных орбиталей электронами с противоположно направленными спинами согласно принципу Паули.!”
Правило Минимума Энергии:
Электроны заселяют атомные орбитали, начиная с подуровня с меньшей энергией.
1s < 2s < 2p < 3s < 3p < 4s ≤ 3d < 4p < 5s
(1.2) Приведите примеры.
|
1H |
1s1 |
= |
||
|
2He |
1s2 |
= |
||
|
3Li |
1s2 2s1 |
= |
[2He] |
2s1 |
|
4Be |
1s2 2s2 |
= |
[2He] |
2s2 |
|
5B |
1s2 2s2 2p1 |
= |
[2He] |
2s2 2p1 |
|
6C |
1s2 2s2 2p2 |
= |
[2He] |
2s2 2p2 |
|
7N |
1s2 2s2 2p3 |
= |
[2He] |
2s2 2p3 |
|
8O |
1s2 2s2 2p4 |
= |
[2He] |
2s 2p4 |
|
9F |
1s2 2s2 2p5 |
= |
[2He] |
2s2 2p5 |
|
10Ne |
1s2 2s2 2p6 |
= |
[2He] |
2s22p6 |
|
11Na |
1s2 2s2 2p6 3s1 |
= |
[9Ne] |
3s1 |
|
12Mg2 |
1s2 2s2 2p6 3s2 |
= |
[10Ne] |
3s2 |
|
13Al |
1s2 2s2 2p6 3s2 3p1 |
= |
[10Ne] |
3s2 3p1 |
|
14Si |
1s2 2s2 2p6 3s2 3p2 |
= |
[10Ne] |
3s2 3p2 |
|
15P |
1s2 2s2 2p6 3s2 3p3 |
= |
[10Ne] |
3s2 3p3 |
|
16S |
1s2 2s2 2p6 3s2 3p4 |
= |
[10Ne] |
3s2 3p4 |
|
17Cl |
1s2 2s2 2p6 3s2 3p5 |
= |
[10Ne] |
3s2 3p5 |
|
18Ar |
1s2 2s2 2p6 3s2 3p6 |
= |
[10Ne] |
3s2 3p6 |
|
19K |
1s2 2s2 2p6 3s2 3p6 4s1 |
= |
[18Ar] |
4s1 |
|
20Ca |
1s2 2s2 2p6 3s2 3p6 4s2 |
= |
[18Ar] |
4s2 |
|
21Sc |
1s2 2s2 2p6 3s2 3p6 3d1 4s2 |
= |
[18Ar] |
3d1 4s2 |
|
22Ti |
1s2 2s2 2p6 3s2 3p6 3d2 4s2 |
= |
[18Ar] |
3d2 4s2 |
|
23V |
1s2 2s2 2p6 3s2 3p6 3d3 4s2 |
= |
[18Ar] |
3d3 4s2 |
|
24Cr |
1s2 2s2 2p6 3s2 3p6 3d4 4s2 |
= |
[18Ar] |
3d5 4s1 |
|
25Mn |
1s2 2s2 2p6 3s2 3p6 3d5 4s2 |
= |
[18Ar] |
3d5 4s2 |
|
26Fe |
1s2 2s2 2p6 3s2 3p6 3d6 4s2 |
= |
[18Ar] |
3d6 4s2 |
|
27Co |
1s2 2s2 2p6 3s2 3p6 3d7 4s2 |
= |
[18Ar] |
3d7 4s2 |
|
28Ni |
1s2 2s2 2p6 3s2 3p6 3d8 4s2 |
= |
[18Ar] |
3d8 4s2 |
|
29Cu |
1s2 2s2 2p6 3s2 3p6 3d10 4s1 |
= |
[18Ar] |
3d10 4s1 |
|
30Zn |
1s2 2s2 2p6 3s2 3p6 3d10 4s2 |
= |
[18Ar] |
3d10 4s2 |
|
31Ga |
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 |
= |
[18Ar] |
3d10 4s2 4p1 |
|
32Ge |
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 |
= |
[18Ar] |
3d10 4s2 4p2 |
|
33As |
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 |
= |
[18Ar] |
3d10 4s2 4p3 |
|
34Se |
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 |
= |
[18Ar] |
3d10 4s2 4p4 |
|
35Br |
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 |
= |
[18Ar] |
3d10 4s2 4p5 |
|
36Kr |
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 |
= |
[18Ar] |
3d10 4s2 4p6 |
(2) Какое максимальное число электронов ,у атома в электронном слое характерезуемом n=5 ?
Максимальное число электронов на слое можно найти с помощью формулы
N=2n2
N-число электронов на слое, n-номер слоя.
Таким Образом при номере слоя n=5 , N = 2*52 = 50
(3) Почему энергия ионизации атома кислорода меньше чем азота ?
Энергиея ионизации атома - I
Это количество энергии, необходимое для отрыва электрона от невозбужденного атома выражается в кДж∙моль–1 или эВ∙атом–1. потенциал ионизации E = e-·I.
Э+ – e– = Э+, ΔH = I1 – первый потенциал ионизации;
Э – e– = Э2+, ΔH = I2 – второй потенциал ионизации и т.д. I1 < I2 < I3 < I4...
Чем больше электронов на внешнем электронном слое, тем больше энергия ионизации.
С увеличением радиуса атома энергия ионизации уменьшается.
Этим объясняется уменьшение металлических свойств в периодах слева направо и увеличение металлических свойств в группах сверху вниз.
Кислород 8O 1s2[↑↓] 2s2 [↑↓] 2p4[↑↓][↑ ][↑ ]
Азот 7N 1s2[↑↓] 2s2 [↑↓] 2p3[↑ ][↑ ][↑ ]
Во-первых Азот(7N) в периодической таблице Менделеева находится левее кислорода(8O ) следовательно радиус атома как и заряд увеличивается , а энергия ионизации уменьшается.
Во-вторых Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов (рис. 2.4).
I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду I1 резко понижается – он минимален у щелочных металлов.
|
|
Энергия связи электрона с ядром пропорциональна Z и обратно пропорциональна среднему (орбитальному) радиусу оболочки. Атомные радиусы d- и f-элементов с ростом Z в периоде уменьшается незначительно по сравнению с s- и p-элементами, поэтому их потенциалы ионизации растут также незначительно.
В главных подгруппах потенциалы ионизации с ростом Z уменьшаются вследствие увеличения числа электронных подоболочек и экранирования заряда ядра электронами внутренних подоболочек.
В побочных подгруппах d-электроны экранируются не только электронами заполненных оболочек, но и внешними s-электронами. Поэтому потенциал ионизации d-элементов с ростом Z в подгруппе увеличивается, хотя и незначительно
(4) Рассчитайте третий потенциал ионизации атома лития
Энергия ионизации – минимальная энергия, необходимая для удаления электрона из нейтрального несвязанного (газофазного) атома, находящегося в основном состоянии. Значение Eи всегда является положительным. Например, энергия ионизации атома водорода
Н
(г.) = Н+ (г.) + e, равная +1312,1 кДж/моль,
относится к переходу с 1s-атомной орбитали (АО) на АО с n = ![]() , которой
отвечает E
, которой
отвечает E![]() = 0.
= 0.
(5) Какие степени окисления для атомов с валентной электронной
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.