Санкт-Петербургский Институт точной механики и оптики
(Технический университет)
Отчёт по
лабораторной N10
Определение теплоты растворения соли.
студента факультета Компьютерных технологий и управления
группа 147
Арановского Станислава Владимировича.
Санкт-Петербург 2001.
Теория:
Термохимия – раздел химической термодинамики, использующий общие законы термодинамики.
В термодинамике введина функция состояния, названная энтальпией
H=U+pV
Таким образом, конечное изменение энтальпии:
DH=DU+DpV
1-ый закон термохимии – закон Лавуазье – Лапласса – формулируется следующим образом: теплота реакции получения продуктов из реагентов равна при тех же условиях теплоте реакции получения геагентов из продуктов, но с противоположным знаком.
2-ый закон термохимии – закон Гесса – формулируется следующим образом: теплота реакции не зависит от пути её протекания, но зависит от начального и конечного состояний системы.
Таким обзразом для любой произвольной реакции aA +bB ® mM + nN, энтальпия реакции равна
DH = (mDH(M)+nDH(N))-(aDH(A)+bDH(B))
Используя закон Гесса, можно рассчитать энтальпию растворения в-ва, если известеы энтальпии образования в-ва и ионов.
Определение теплоты растворения соли:
Теплоту растворения одного моля можно рассчитать по уравнению
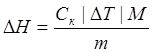
где m-масса соли,M-мольная масса вещества.
Масса соли ![]() =5гр.
=5гр.
Время работы нагревателя – 3 минуты.
Сопротивление нагревателя 6 Ом.
Сила тока 0,9А.
![]()
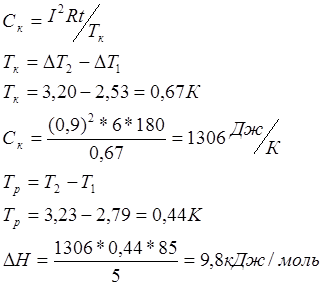
Приведём рассчёт теоретического значения изменения энтальпии:
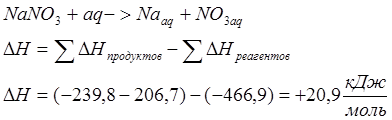
![]()
Таким образом, погрешность экспериментальных измерений составляет
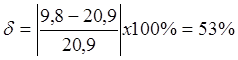
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.