





















Основы химии и технологии производства полистирола заложили Остромысленский и Штаудингер. Первый патент на получение полистирола (способом термической спонтанной полимеризации в массе) был взят в Германии в 1911 г. Там же в 1920 г. началось промышленное производство полимера. В 1936 г. уже производилось 6000 т/год. Изначально стоимость стирола была очень высокой, однако создание крупнотоннажных производств полимеров в США и других странах в годы второй мировой войны послужило стимулом к развитию технологий получения мономера, как следствие, уменьшению его стоимости [4].
Промышленное производство стирола в нашей стране было организовано в 1949 г. на Воронежском заводе синтетического каучука из этилбензола, получаемого алкилированием бензола. В 60-х годах установки алкилирования с использованием этилена обратного коксового газа мощностью не более 10 тыс. т/год создаются на заводах по производству синтетического аммиака. В 1966 – 70 гг. строятся уже специальные цехи по производству этилбензола и стирола на его основе мощностью 40 тыс. т/год на нефтехимических предприятиях. В период с 1976 – 80 гг. вводятся в строй мощные специализированные системы по производству стирола из этилбензола в ПАО «Нижнекамскнефтехим», на заводе пластмасс в г. Шевченко, в Узловском ПАО и др. Мощность этих систем достигает 300 тыс. т/год [2].
В 1972 г. мировой объем производства стирола составил, включая социалистические страны, почти 5 млн. т.
Крупнейшим производителем стирола являются США. В 1972 г. суммарная мощность всех установок синтеза в США составила свыше 2 млн. т. Оптимальными в экономическом отношении считаются крупные установки мощностью 90—227 тыс. т/год. Однако число таких установок даже в США тогда было невелико. Себестоимость 1 т стирола (в ценах 1970 г.) составляла около 110 долларов при себестоимости 1т этилена около 66 и 1 т бензола около 75 долларов.
В Японии за период с 1969 по 1972 г. производство стирола выросло в 2 раза и достигло 880 тыс. т/год. Известно, что восемь японских фирм — основных производителей мономера — использовали пять лицензий американских и международных корпораций.
Производство стирола интенсивно развивалось и в других капиталистических странах. Несмотря на это, в то время на мировом рынке ощущался острый дефицит этого мономера [4].
В 1987 г. мировое производство стирола составляло уже порядка 11 млн. т/год [5].
Стирол почти исключительно применяется для производства полимеров. Большая часть (более 60 %) расходуется на получение собственно полистирола, ещё около 12% – бутадиен-стирольного каучука [4], остальное в основном идёт на производство других сополимеров, в т.ч. с акрилонитрилом, винилхлоридом [2].
В меньших количествах стирол применяется в качестве растворителя полиэфирных пластмасс и для модификации алкидных полимеров, а также в качестве добавки к моторному топливу[2]. Помимо этого, стирол является очень востребованным веществом при производстве стирол-акриловых дисперсий, применяемых во всех процессах строительства и ремонта. Такие дисперсии незаменимы в составе различных клеев и водоэмульсионных красок [8], кроме того, стирол входит в некоторые составы напалмов.
Таблица 2 – Структура потребления стирола в США (1975 г.) [7]
|
Продукт |
Объём, тыс. т/год |
Доля, % |
|
Полистирол обычиый |
656,4 |
25 |
|
Полистирол ударопрочный и модифицированный каучуком |
813,9 |
31 |
|
Бутадиен-стирольный каучук и латекс |
367,6 |
14 |
|
Смолы АБС и САН |
262,6 |
10 |
|
Ненасыщенные полиэфирные смолы |
157,5 |
6 |
|
Стиролбутадиеновые смолы |
183,8 |
7 |
|
Прочие области потребления |
183,8 |
7 |
Основной реакцией получения стирола является дегидрирование этилбензола, который, в свою очередь, получается алкилированием бензола этиленом.
|
(1) |
|
(2) |
Первая реакция протекает при 400-450 ºС в присутствии AlCl3 или BF3 на модифицированном оксиде алюминия, вторая это эндотермическое дегидрирование этилбензола в присутствии Fe2O3, промотированного CrO3, KOH (NaOH) или V2O5 в газовой фазе при 580-650 ºC [1].
|
|
(3) |
|
(4) |
|
|
|
(5) |
Метатезис - химическая реакция, в процессе которой происходит перераспределение заместителей при двойных связях участвующих в реакции алкенов.
|
|
(6) |
|
(7) |
|
|
(8) |
Основной реакцией для стирола является полимеризация с образованием полистирола, пенополистирола, а также сополимеризация с образованием АБС (акрилонитрил-бутадиен-стирол) и САН (стирол-акрилонитрил) пластиков.
Помимо этого, стирол обладает свойствами олефинов, может присоединять в боковую цепь Cl2 и Br2 (реакцию с Вr2 в ССl4 применяют для количественного определения стирола), с HBr, HCl и HCN дает продукты присоединения по правилу Марковникова. Легко окисляется, в зависимости от природы окислителя может образовывать различные продукты [6] (см. рисунок 2).
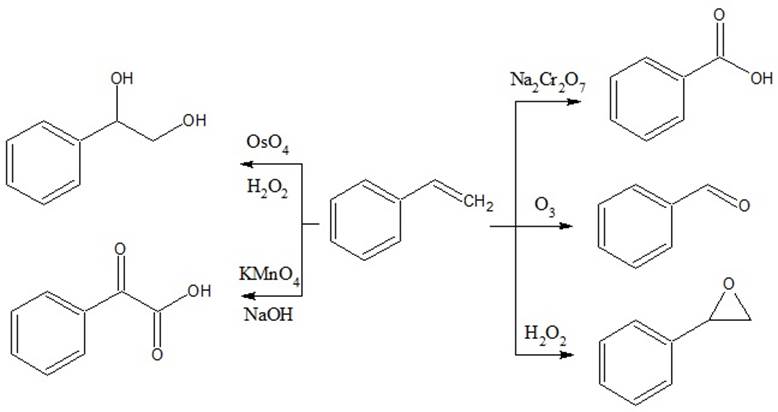 Рисунок
2 – Окисление стирола
Рисунок
2 – Окисление стирола
Гидратация стирола в присутствии солей Hg (II) с последующим
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.